Volver a ¨Psicofarmacología – Psicodinámica IV (Indice General)¨
Desde hace algunas décadas se conoce que las conductas humanas están estrechamente relacionadas con los sistemas neuroendocrinos e inmunológicos. Esta intersección en el campo de las neurociencias entre la Endocrinología, la Neurología, la Inmunología y la Psiquiatría se la denomina Psicoinmunoendocrinología.
Fue Harvey Cushing, en 1913, quien dijo:
[ … ] que las condiciones psíquicas influencian las descargas de las glándulas de secreción interna, y que la dificultad consiste en determinar cuál es el factor primario: si el psíquico o el desequilibrio de la secreción interna…
Unos 20 años después, describió la enfermedad que lleva su nombre, caracterizada por presentar un depósito de grasas en el cuello, en forma de búfalo, pero además los pacientes muestran cambios psicológicos como son la irritabilidad, la falta de concentración y la depresión.
Existen enfermedades inmunoneuroendocrinas, que también presentan síntomas depresivos como es la Enfermedad de Addison, el hipo o hipertiroidismo, el hiperparotiroidismo, algunas neoplasias, la esclerosis, algunas infecciones virales, el SIDA, las deficiencias de B12 y ácido fólico y la uremia, entre otras.
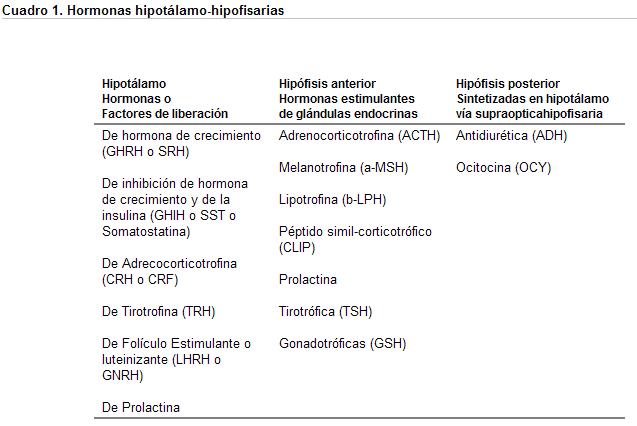
El estudio de estas anomalías es conocido como la «ventana neuroendocrina del cerebro», basado en que la secreción de hormonas por las glándulas periféricas, son controladas por las hormonas tróficas de la hipófisis, y a su vez éstas son estimuladas o inhibidas por la secreción de hormonas liberadoras o inhibidoras producidas en el hipotálamo. Estos factores de liberación o inhibición son regulados por neurotransmisores como la acetilcolina (Ac), la noradrenalina (NA), la dopamina (DA), la serotonina (5-HT), etc.
En los últimos años se pudo demostrar que el eje límbico-hipotálamohipofisario, que controla la producción de hormonas de las glándulas de secreción interna (suprarrenal, tiroides), de las intrahipofisarias (somototrófico-hormona de crecimiento y prolactina) y de las de la hipófisis posterior (antidiurética, ocitocina) revisten importancia para la Psiquiatría, y son algunos de estos ejes que se considerarán en este capítulo.
Ello se debe a que las diferencias absolutas o relativas de las hormonas entre sí o luego de inhibir o estimular los ejes con determinados fármacos, dan cuenta de las alteraciones endocrinológicas y de diferentes neurotransmisores, que son en definitiva los que presentan los disbalances que se investigan en los trastornos psiquiátricos y que el tratamiento psicofarmacológico trata de corregir.
Sólo 2 péptidos son inhibitorios de la secreción hipofisaria: la somatostatina (SOM), que inhibe la secreción de hormona de crecimiento (GH) y de la tirotrófica (TSH), y la dopamina que sería el factor inhibitorio de la secreción de prolactina (PRL) hipofisaria.
Las respuestas de estas hormonas «trópicas» hipofisarias dependen de influencias de factores neurohormonales liberadores (releasing) y/o inhibidores (inhibiting), a cuyas acciones se suman, de manera casi algebraica, variables psicológicas (mediadas por neurotransmisores, neuromediadores, etc.) y hormonales propiamente dichas (mediados por hormonas periféricas específicas), que a su vez dependen de sus respectivos feedbacks positivos o negativos.
Así por ejemplo, el estrés crónico produce elevación plasmática de los glucocorticoides y disminución de hormonas hipofisarias, como son las gonadotrofinas de tipo Luteinizante (LH) y de tipo Folículo-estimulante (FSH), la TSH, la PRL y GH. Estos descensos de los niveles plasmáticos, además de ocasionar las lógicas alteraciones en las glándulas periféricas, producen a través de la prolactina y de la hormona de crecimiento, una franca disminución de las defensas inmunológicas.
Las acciones inmuno-neuroendocrinológicas se manifiestan a través de la disminución de la liberación de las Interleukinas y del Factor de Necrosis Tumoral, que producen los macrófagos. Se disminuye así el potencial de respuesta a las infecciones e inflamaciones.
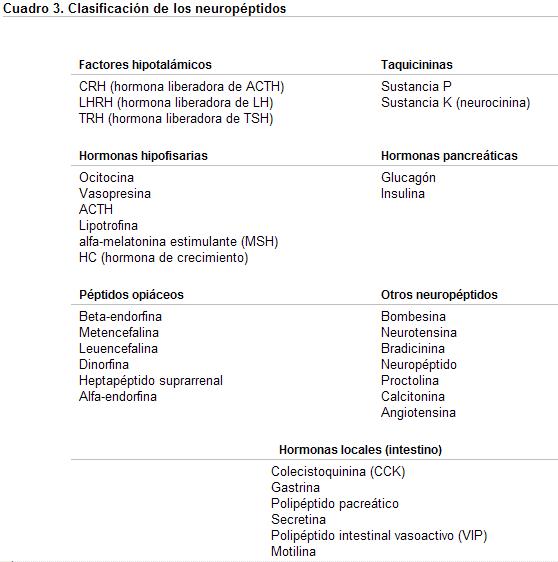
Los neurotransmisores propiamente dichos, que actúan en la sinapsis o los que actúan a distancia llamados neuropéptidos, neurohormonas o inmunoneuropéptidos, influyen sobre distintos grupos neuronales del sistema nervioso central y sobre el propio eje córtico-hipotálamo-hipofisario.
Los psicofármacos, cuyos mecanismos de acción son a través de los neurotransmisores, actúan por vía indirecta o directa en la secreción de ciertas hormonas, alterando así los efectos que las mismas producen normalmente sobre los diferentes ejes hipotálamo-hipofiso-periféricos. Los neurotransmisores endógenos, y las modificaciones que producen los psicofármacos sobre ellos, actúan en el hipotálamo, originando la inhibición o liberación de hormonas y, controlan -por esta vía indirecta- las funciones hipofisarias, y por ende a las glándulas de secreción interna.
2-1. Inmunoneuropéptidos
Deberían denominarse psiconeuroinmunopéptidos
o psiconeuroinmunoproteínas, ya que se forman y actúan a distancia, por la interacción entre los sistemas inmunitario, endocrino y psíquico.
Los inmunoneuropéptidos son polipéptidos, que se originan en las neuronas del hipotálamo y áreas vecinas. Se caracterizan por ser condensaciones de varios aminoácidos, cuyas uniones se realizan entre los grupos amino y ácido de sus extremos. Los dipéptidos o tripéptidos se asemejan en sus propiedades a los aminoácidos, en tanto que los polipéptidos presentan mayor semejanza con las proteínas. Arbitrariamente se llama polipéptidos a los que presentan un peso molecular inferior a 6000, y proteínas, a los de peso molecular mayor.
1) Péptidos del hipotálamo límbico
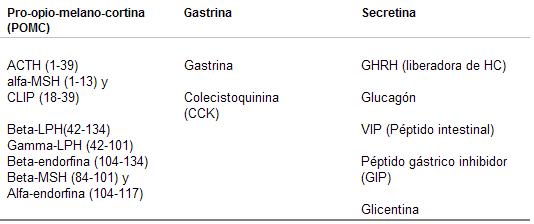
De la Pro-opio-melano-cortina (PONIQ gigante se originan, de acuerdo con sus ptintos de escisión los siguientes neuropéptidos y neurohormonas:
1) Adrenocorticotrofina (ACTH), del aminoácido 1 al 39;
2) B-Lipotrofina (P-LPH), del aminoácido 42 al 134;
3) Melatonina-estimulante (P-MSH), del aminoácido 84 a 101;
4) Endorfinas, del aminoácido 104 al 134.
Estas últimas son péptidos simil-opiáceos, tienen el mismo origen que la ACTH y se caracterizan por ligarse a los mismos receptores, a los cuales se une la morfina. Estos receptores son bloqueados por la naloxona (usada como tratamiento de deshabituación de los adictos a la morfina).La llamada ACTH gigante, que se creía presente sólo en la adenohipófisis, se ha encontrado también en el hipotálamo y en las terminaciones axónicas de la hipófisis.
Cuadro 5. Familias hormonales génicamente agrupadas.
(Distribuidas en el Sistema Nervioso Central y Periférico, con características de neurotransmisores)
Desde el punto de vista psicofarmacológico, la ACTH y la MSH intervienen en los procesos de memoria (de largo y mediano plazo) y facilitan el aprendizaje, juntamente con la ocitocina y la vasopresina. Estas dos últimas tendrían una acción propia o bien, probablemente, actuarían promoviendo la liberación de ACTH.
Los péptidos opiáceos (endogenous morphine-likefactors) se caracterizan por ligarse a los mismos receptores a los que se une la morfina. Estos receptores son bloqueados por la naloxona.
Regularían la tolerancia y abstinencia a través del control sobre la noradrenalina, la proteína G y la liberación de hormonas hipofisarias en el tegmento ventral y núcleo accumbens («área de la recompensa»).
Existen varios receptores: mu, delta, kappa y sigma.
Los receptores mu, ubicados en el locus coeruleus, estarían relacionados con la euforia, y los localizados en el tálamo e hipotálamo, con el dolor.
Los de tipo delta, localizados en el sistema límbico, se asocian a la emoción, la rigidez muscular y la catalepsia.
A los de tipo kappa se los encuentra en la médula espinal y el tronco cerebral, y se los relaciona con la analgesia. Tienen bajo poder adictivo.
Los de tipo sigma no son sensibles a la naloxona y aparecen en el hipocampo.
Las beta-endorfinas tienen una acción analgésica 30 veces superior a la de la morfina y producen sedación y catatonía.
Las encefalinas se pueden hallar también en las interneuronas de la médula espinal, donde inhiben la liberación de la sustancia o neuropéptido «P», que es un activo neurotransmisor del dolor. Las encefalinas, a diferencia de las endorfinas, provocan una reacción euforizante y estimulante sexual. La hipnosis y la acupuntura activarían los receptores opiáceos por liberación de encefalinas.
Las beta-endorfinas presentan una actividad similar a la de los neurolépticos. Producen sedación y catatonía, aumentan la liberación de prolactina y disminuyen la respuesta corticoidea. Esta acción estaría mediada por un mecanismo de feedback negativo con el factor de liberación de ACTH, ya que ambos tienen el mismo precursor neurohormonal.
Por otra parte, se pensó que bloqueando estos receptores opiáceos con naloxona se podría mejorar a los pacientes esquizofrénicos.
Sin embargo, con infusión intravenosa de 4-15 mg de beta-endorfina y de 0,4-0,8 mg de naloxona se obtuvieron resultados contradictorios, desde mejoría hasta empeoramiento, según los diferentes investigadores.
La neurotensina se encuentra en los mismos lugares que las encefalinas. Produce sedación y una reacción intensa hipotérmica. Aumenta la secreción de gonadotrofinas, ACTH y glucagón.
2) Péptidos del hipotálamo endocrino
a) TRH.- hormona liberadora de tirotrofina. Este factor u hormona liberadora tiene la capacidad de liberar a la circulación sanguínea tirotrofina (TSH) de la hipófisis anterior. Desde el punto de vista psicofarmacológico, antagoniza la sedación y la hipotermia provocadas por barbitúricos, y posee un efecto analéptico central en animales de laboratorio. Estimula la liberación a nivel presináptico de neurotransmisores catecolamínicos.
Administrada por vía intravenosa posee una rápida y fugaz acción antidepresiva. Cuando se la administra juntamente con L-dopa produce efectos antiparkinsonianos. Puede agravar a pacientes con características paranoides.
b) LH-RH. hormona liberadora de hormona luteinizante y folículo-estimulante. Provoca la liberación de hormona luteinizante (LH) y folículo-estimulante (FSH) de la hipófisis anterior.
Administrada por vía intramuscular o intravenosa en hombres con impotencia sexual, mostró un efecto de incremento notable de la libido sexual, independientemente de sus acciones endocrinas específicas sobre el aparato gonadal.
c) SRIF.- somatostatina u hormona inhibidora de la liberación de hormona de crecimiento. Inhibe la secreción de hormona de crecimiento (HC), de insulina, glucagón, gastrina, pepsina, renina, TSH y ACTH.
Su secreción disminuye en las etapas no-REM del sueño, durante las cuales aumenta notablemente la secreción de hormona de crecimiento.
En animales de experimentación provoca sedación e hipotermia.
d) MIF.- hormona inhibidora de la liberación de hormona estimulante de los melanocitos. En la actualidad se conocen dos sustancias hipotalámicas diferentes (MIF1 y MIF 2).
Tiene acción potenciada de la L-dopa y provoca un aumento de síntesis de la dopamina, por lo cual resulta de utilidad en la enfermedad de Parkinson.
e) PRF-PIF. factor liberador de la prolactina-factor inhibidor de la prolactina. La secreción de prolactina por la hipófisis está regulada por la relación existente entre el PRF y el PIF, El PRF sería liberado por la serotonina, en tanto que el PIF lo sería por la dopamina.
En la actualidad está en discusión si el PRF no sería en realidad la serotonina y el PIF la dopamina.
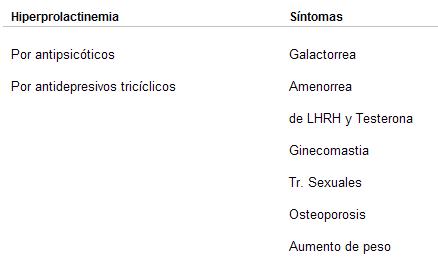
Los fármacos antipsicóticos, por ser bloqueantes de los receptores dopamínicos, producen un aumento de prolactina que provoca ginecomastia en el hombre, asociada o no a impotencia o esterilidad, y amenorrea con anovulación en la mujer.
Esta acción se debería a una disminución del PIF por falta de estimulación dopamínica.
A la prolactina se la ha relacionado con los cambios de conducta premenstrual y del humor durante el embarazo y el posparto. Algunos autores señalan que, de acuerdo con el nivel sanguíneo de esta hormona y la correlación con los niveles de progesterona y/o estrógenos, se observa irritabilidad, tensión y depresión.
Del grupo de la gastrina se origina la colcecistoquinina y del grupo secretina la hormona liberadora de la hormona de crecimiento, el glucagón y otros péptidos.
Desde el punto de vista psicofarmacológico, la ACTH y lab-MSH intervienen en los procesos de memoria (de largo y mediano plazo) y facilitan el aprendizaje. Contribuyen a este proceso las hormonas originadas en el lóbulo posterior de la hipófisis: la Ocitocina (OC) y la antidiurética o vasopresina (ADH). Estas dos últimas tendrían una acción propia, o bien actuarían promoviendo la liberación de ACTH
Las neuronas 1 (peptidérgicas), secretan sus péptidos en el plexo portal hipofisario, las neuronas 2 y 3 (moaminérgicas), secretan NA y DA, involucradas en la regulación de las hormonas hipofisarias (GH, PRL, ACTH, ß-Endorfina, TSH, FSH y LH), las neuronas 4 (magno celulares peptidérgicas del tracto neurohipofisario posterior), que tienen sus cuerpos celulares en el Núcleo Supraóptico (SON) y en el Paraventricular (PVN), cuyos axones terminan en la neurohipófisis posterior responsables de la secreción de la hormona antidiurética y la ocitocina (aquí también se encontraron dinorfinas, colecistoquinina y angiotensina II).
2-2. Eje límbico-hipotálamo-hipófiso-suprarrenal
Su disregulación en situaciones de estrés crónico le permite un funcionamiento aberrante, con independencia del control cortical consciente y acciones propias sobre el eje adrenal. Al tener los esteroides receptores citosólicos, actúan directamente sobre la transcripción nuclear genética y pueden alterar la traducción proteica, con los consiguientes cambios conductuales.
Este eje ha sido foco de mucha especulación, no sólo por la alteración demostrable en el test de supresión a la dexametasona, sino porque en la depresión mayor, la hipercortisolemia, como consecuencia del estrés, es lino de los hallazgos biológicos más constantes de la psiquiatría.
La actividad de este eje está regulada por la secreción de la hormona liberadora de corticotrofina (CRH) del hipotálamo y por el feedback negativo de los glucocorticoides sobre las neuronas del CRH hipotalámico y de la de ACTH de la hipófisis.
Este aumento de la CRH produce:
– una respuesta anormal, a los tests de estimulación de la hormona de crecimiento;
– una disminución de la serotonina;
– una respuesta anormal de la TSH, a la estimulación producida por TRH, en los depresivos mayores [en un 25 % de los pacientes las respuestas son aplanadas (hiporrespuestas) y en un 15 % las respuestas está aumentadas] (ver definiciones más adelante);
– una respuesta positiva o «no supresora» a la prueba de inhibición a la dexametasona (en el 50 a 75 % de los pacientes depresivos mayores),
– un aumento del cortisol plasmático.
2-3. Hormona liberadora de adrenocorticotrofina (CRH)
En el SNC se encuentra ampliamente difundido en la corteza cerebral, en áreas límbicas (amígdala, hipocampo y núcleo accumbens), interactuando con las respuestas emocionales frente a las situaciones de adaptación y estrés.
El CRH fue localizado a nivel del hipotálamo; modula y regula la secreción de ACTH de las células de la hipófisis anterior. Tiene una distribución y una localización muy difundida en el sistema nervioso central (SNC) y periférico.
Todos estos circuitos se encuentran en una estrecha interrelación con los núcleos hipotalámicos, que fueron los primeros descritos conteniendo neuronas ricas en CRH. Forma un verdadero sistema entre el tálamo, la amígdala, la corteza cerebral y sobre todo, la corteza prefrontal, determinando muchos de los efectos conductuales y corporales.
Tiene 41 aminoácidos, difiere solamente en siete aminoácidos entre el del hombre y de otras especies. Como ironía baste decir que el CRH del hombre y de la rata son exactamente idénticos en su secuencia aminoacídica.
Además de las acciones endocrinas, se almacena en vesículas más claras, cuyo contenido se libera al espacio intersináptico en función de determinados estímulos e interactúa con neuronas postsinápticas que poseen receptores específicos.
Se conocen dos subtipos de receptores metabolotrópicos para CRH: uno central de menor peso molecular y uno periférico. Ambos actúan a través de la proteína G e incremento de niveles de AMP cíclico, confiriéndole un verdadero carácter de neurotransmisor (ver cap. 1).
Existe una proteína transportadora plasmática que inhibe los efectos biológicos del CRH. En el embarazo existe una gran producción de CRH por la placenta, sin embargo no cursa con niveles incrementados de cortisol plasmático y ello se debe a que durante el embarazo hay un aumento de la síntesis y circulación de esta proteína transportadora que actúa como un verdadero antagonista del CRH. También por poseer una conformación este re oisométrica particular tiene efectos antagonistas sobre su receptor específico.
El CRH es el principal, aunque no el único, modulador de la transducción, transcripción y activación de péptidos derivados de la propiomelanocortina (POMC). A partir de diferentes porciones de clivaje de esta molécula pueden obtenerse entonces la ACTH, moléculas con acción opioidea, derivados con acción hormonal y trófica y también moléculas con acción inmunológica.
El CRH se encuentra en el hipotálamo, pero fundamentalmente en el núcleo paraventricular y en la corteza cerebral, teniendo que ver con la modulación de la cognición, en hipocampo (ésta es una de las principales vías de regulación de la actividad del CRF), la amígdala, área tegmental ventral y núcleo accumbens, locus coeruleus, núcleo parabraquial y complejo vagal dorsal. A partir de esta distribución hay una importante modulación de la respuesta autonómica, ya que existe gran densidad de CRH en la médula espinal, formando verdaderos sistemas ascendentes y descendentes en cuernos dorsal y ventral respectivamente. Es muy interesante señalar que en tejidos periféricos como tracto gastrointestinal, testículos, bazo y páncreas, hay gran localización y distribución de CRH.
El CRH tiene junto con el sistema catecolaminérgico la función de ajustar los mecanismos adaptativos frente a la aparición de cualquier factor estresante:
– aumento de la activación y vigilancia,
– disminución del tiempo de sueño, y
– efectos bifásicos en experimentación animal.
Si el animal está en un contexto habitual y conocido, la administración de CRH produce un aumento en la activación locomotora. En cambio, si está en un contexto absolutamente desconocido, es muy frecuente que la actividad locomotora se paralice dramáticamente.
Cuando se activa el sistema mediado por CRH, existe tina disminución de la conducta alimentaria y de la conducta sexual y, un incremento de la conducta agresiva (a través del sistema parasimpático). Interviene en acciones a nivel gastrointestinal con disminución de la secreción y vaciamiento gástrico e intestinal y aumento del tránsito colónico y la excreción fecal tanto por acciones centrales como periféricas.
A partir del clivaje específico de la molécula POMC existe una producción de derivados leucocitarios con acción sobre el sistema inmunitario, con estímulo a cierto tipo de interleuquinas (IL-1 y 2) y a nivel de la pulpa roja del bazo con aumento de la actividad de macrófagos y de proliferación de linfocitos.
También se ha visto que en ciertas situaciones, como por ejemplo la artritis reumatoidea existe un incremento de la actividad de CRH a nivel local con acciones pro-inflamatorias por mecanismos autocrinos y paracrinos.
Estimulan la producción, la síntesis y la liberación de CRH los siguientes sistemas:
– el estrés,
– vías serotoninérgicas (receptores 5-HT IA, 5-HT IC y 5-HT 2),
– vías colinérgicas (receptores muscarínicos y nicotínicos),
– vías noradrenérgicas (receptores alfa), y
– sistemas opioides (receptores kappa).
Todos ellos deben encontrarse en equilibrio con aquellos sistemas que inhiben la liberación de CRH:
– GABA, – glucocorticoides (mecanismos de feedback inhibitorio), – noradrenalina (mecanismo de feedback negativo), – ACTH y – opioides mediante (receptores Mu).
La acetilcolina estimula el locus coeruleus, y el GABA lo inhibe; la noradrenalina es su principal transmisor y, a su vez, tiene propiedades estimulantes o inhibidoras, no muy bien conocidas, de la liberación de CRH. La serotonina estimula la liberación de CRH y sería responsable de su periodicidad circadiana (de allí la utilidad de los IRSS en la depresión y en el síndrome de fatiga crónico).
Existe un pico de secreción de cortisol en las primeras horas del día y, que paulatinamente se agota en las últimas horas de la noche. Esta alteración es observable (con la alteración de la melatonina), en el jet-lag, por cambios del ciclo luz-oscuridad. Produce insomnios severos en algunos sujetos, que realizan vuelos intercontinentales.
CRH y esteroides adrenales
El CRH modula la actividad de los esteroides adrenales: la de los glucocorticoides (cortisol y gluconeogénesis) y la de los mineralocorticoides (aldosterona y retención de sodio).
Además de los efectos particulares que tiene el CRH sobre la conducta y sobre distintas estructuras, existen acciones propias de los esteroides adrenales. Por ejemplo tienen estos últimos efectos neurológicos y conductuales (estímulo alimentario al comienzo del día; desarrollo de obesidad en individuos que están genéticamente predispuestos; acciones sobre el aprendizaje, a nivel del hipocampo; regulación de la presión arterial, a partir del balance en la ingesta de sal).
También y de una manera bifásica, tienen efectos neuroprotectores y efectos neurotóxicos con diferente localización anatómica. Por ejemplo los efectos neuroprotectores están localizados a nivel del giro dentado y los neurotóxicos a nivel de neuronas piramidales en hipocampo, más relacionados con el envejecimiento normal.
Entonces, cuando no existen factores estresantes importantes, es un eje que funciona con un mecanismo de feedback negativo y una regulación rítmica y cíclica de los niveles del cortisol plasmático.
Cuando el individuo esta sometido a un estrés importante y continuo los glucocorticoides no alcanzan a inhibir las estructuras hipotalámicas, porque empiezan a producirse daños de arborizaciones dendríticas, primero y, luego severo daño neuronal en la estructura del hipocampo. El hipocampo es una de las principales estructuras, que a través de vías gabaérgicas inhiben la actividad del CRH a nivel hipotalámico (ver cap. 1).
La disminución de la acción inhibitoria ejercida por el hipocampo, determina una situación paradojal: altos niveles de glucocorticoides, coexistiendo con niveles elevados de CRH.
Los esteroides adrenales tienen que ver con los mecanismos adaptativos, a través de los receptores esteroides denominados «no genómicos» (receptores de membrana, relacionados a las acciones rápidas de las hormonas esteroideas) y, con los receptores intracelulares o «genómicos» (receptores citoplasmáticos), que una vez activados, producen su ingreso al núcleo celular y generan una alteración de la transcripción y traducción del material genético.
Se conocen dos tipos de receptores esteroides, los Tipo I o mineratocorticoideos y los Tipo II o glucocorticoideos.
Los receptores Tipo I intervienen en la regulación tónica del ritmo circadiano del cortisol, tienen un agonista principal (cortisol), con alta afinidad, que en condiciones normales están ocupados en un 90 %, responden al estímulo del cortisol y tienen bajo umbral y eficacia. Ello significa que estos receptores captan el cortisol y producen, rápidamente, una respuesta leve y suave.
Los receptores Tipo II, normalmente tienen una ocupación no mayor del 50 %, pero en situaciones de estrés intenso, alteran drásticamente esta proporción. El agonista principal (dexametasona), tiene poca afinidad, alto umbral, pero su eficacia es mucho mayor y actúa a nivel de la molécula de ADN, sobre sitios de transcripción específicos, denominados «Elementos Respondedores a Glucocorticoides » (GRE)
Puede haber un incremento del CRH en determinadas áreas con una disminución de receptores por mecanismos de de sensibilización. Ello justifica y explica la existencia de incremento de niveles de cortisol junto a un aumento de los niveles de CRH. Éste es el motivo, como se verá más adelante, para evaluar con el test de inhibición a la dexametasona, la alteración del CRH.
Existen severas enfermedades psiquiátricas y neurológicas con graves alteraciones cognitivas, como son la demencia del tipo Alzheimer, la corea de Huntington y la parálisis nuclear progresiva, donde aparecen una disminución de los niveles de CRH localizado en determinadas áreas.
La activación del CRH por el estrés provoca un aumento de su síntesis, con una consecuencia directa como son los incrementos en la liberación de ACTH, P-endorfina y otros productos derivados de la cadena madre pro-opio-melanocortina (POMC).
Los efectos que se han observado del neuropéptido CRH indican claramente su participación en la respuesta de estrés, así como prefiguran la alteración depresiva. justamente, muchos de los síntomas biológicos de la depresión se asemejan a una respuesta crónica de estrés que no encuentra contrarregulación.
Asimismo, dado el papel obvio (aumento del alerta e inhibición vegetativa) que tiene el locus coeruleus en la generación de la misma respuesta, se ha postulado que dicho núcleo se retroalimentaría positivamente con el eje CRHhipófisis, coordinando uno la preparación conductal y el otro, la física. En este modelo, el locus coeruleus debe estar en hiperfunción crónica, al igual que el eje adrenal, lo que es uno de sus puntos aún no suficientemente validados.
Los ciclos evolutivos normales y las vivencias emocionales traumáticas de una vida emocional («life events») como podrían ser las pérdidas o fracasos reiterados, por ejemplo incidirían en la disfuncionalidad del eje, provocando una regulación descendente o «down regulation » con pérdida de los receptores a glucocorticoideos. De esta manera el estrés crónico facilitaría la producción en exceso de la CRH.
No se debe olvidar que la ansiedad es frecuentemente una manifestación predominante de la respuesta al estrés, y enfoques muy recientes asocian este exceso de CRH a un sustrato común de la depresión y la ansiedad. Por otra parte si se administra CRH a la rata aparecen equivalentes de los síntomas depresivos: pérdida de la libido, insomnio, disminución del apetito y alteraciones psicomotoras. La CRH es la coordinadora de las respuesta endocrinas, autonómicas, conductales e inmunes al estrés.
Este aumento de la CRH implica un aumento de la ACTH hipofisaria y de los glucorticoides de origen suprarrenal.
Si se administra desimipramina en sujetos normales disminuyen los niveles de CRH en LCR y la administración crónica de litio eleva los niveles de glucocorticoides matutinos, ya sea por estimulación de CRH, ACTH o por la alteración del ritmo circadiano.
En la depresión existe:
1) Aumento de la Hormona Liberadora de Corticotrofina (CRH), en plasma y LCR.
2) Aumento de la secreción del cortisol plasmático, por la tarde y noche.
3) Aumento de la excreción del cortisol urinario de 24 hs.
4) Prueba de inhibición a la dexametasona positivo o «no supresor».. no se inhibe la secreción del cortisol plasmático (es mayor a 5 ug/dl en plasma).
5) El test de estimulación con CRH produce una:
– respuesta aplanada de la ACTH (en la E. de Cushing está elevada),
– respuesta normal del cortisol.
6) Disminución de receptores CRH en la corteza frontal de suicidas: «regulación descendente» como consecuencia de la hipersecreción.
7) Agrandamiento del tamaño de la hipófisis.
8) Agrandamiento del tamaño de la suprarrenal (especialmente en pacientes suicidas).
En el trastorno bipolar, a lo anteriormente mencionado habría que agregar, que el test de la dexametasona Presenta una mayor positividad, que en la depresión mayor, y existe un aumento del cortisol plasmático y en LCR pero con mayores variaciones diurnas.
El síndrome de Cushing, puede ser o no ACTH dependiente, según que la hipersecreción de ACTH estimule la glándula suprarrenal o que la glándula aumente la producción de cortisol de manera independiente (ejemplo: una neoplasia), respectivamente. La enfermedad de Cushing es un síndrome con hipersecreción espontánea de ACTH hipofisaria (microadenomas) o hipotalámica de CRH. Son raros los tumores extrahipofisarios productores de CRH-ACTH capaces de estimular la producción del cortisol adrenal (dentro de los más comunes se encuentran el timoma y el carcinoma de «oat cells» pulmonar). La secreción excesiva de ACTH se acompaña de aumento de la Melatonina-estimulante y de otros productos de escisión
Test de estimulación de la CRH
Un método de utilidad para investigar este eje es la prueba de estimulación por CRH. Se administra 1 mg/kg. de peso por vía IV y se mide la respuesta de la ACTH y del cortisol durante un período de 2 a 3 hs.
La respuesta de la curva de ACTH muestra una hiporrespuesta o aplanamiento en pacientes depresivos, en comparación con los normales. Este aplanamiento de la curva de ACTH en pacientes depresivos se debe a la hipersecreción crónica de la CRH En realidad se trata de una regulación descendente o «down regulation «a nivel de la adenohipófisis: los receptores a la CRH disminuyen de manera tal que al ser estimulados producen una menor respuesta de la ACTH). Esta hiporrespuesta de la ACTH está ligada a la prueba de la dexametasona, ya que aparece, de manera más frecuente, en aquellos pacientes que presentan una respuesta positiva es decir «no supresoral, a la dexametasona.
En la depresión mayor, puede entonces existir hipercortisolemia, pero sin elevación de la ACTH, en tanto, que en la enfermedad de Cushing existe aumento del cortisol y del ACTH.
En contraste, en la enfermedad de Cushing, existe una hiperproducción de las células corticotrópicas de la hipófisis, que escapan al control inhibitorio que ejerce la CRH de origen hipotalámico. A su vez la producción de CRH está doblemente inhibida: a la inhibición normal por cortisol se agrega el notable del cortisol circulante. Las células corticotrópicas hipofisarias se vuelven alitónomas y producen mayor cantidad de ACTH escapando al control inhibitorio del cortisol y del CRH. Por consiguiente, si se estimula con CRH, existen mayor número de receptores en condiciones de responder, con una descarga aumentada de ACTH.
En la depresión mayor, pudo comprobarse en estudios «post mortem «, realizados sobre la corteza frontal de pacientes suicidados, la disminución de los receptores a CRH y agrandamientos de la hipófisis y suprarrenal, que comparados con normales muestran una disminución de los receptores, con conservación -en ambos grupos- de la afinidad a los receptores a CRH.
Este extraño equilibrio del eje corticoideo en la depresión donde hay hipercortisolemia, pero sin elevación de la ACTH -como presenta la enfermedad de Cushing- se explica porque, en un principio, existe una producción excesiva de CRH -con la secundaria hipersecreción de ACTH- originada en el aumento del CRH. La glándula suprarrenal termina por hacer una hiperplasia o hiperreactividad a la ACTH. El feedback inhibitorio -a nivel de la CRH-, no es operante y la célula corticotrópica de la hipófisis termina siendo tomada entre los influjos adrenales inhibitorios del cortisol y los excitatorios hipotalámicos del CRH, resultando en un valor normal de ACTH, pese al nivel de hipercortisolemia circulante.
Algunos pacientes, que intentaron suicidarse, presentaban un aumento de los 17-hidroxicorticoides urinarios de 24 hs.
Se conoce desde hace mucho tiempo, que los glucocorticoides y mineralocorticoides protegen y adaptan las respuestas neuronales y gliales. Ello se produce ya que los mismos actúan sobre los receptores neurocorticoideos I y II. Los de tipo I se localizan en el hipocampo (parte constitutiva del sistema límbico) y los de tipo II en la glía y otras regiones del cerebro.
La depresión sería en realidad una falla de adaptación al aumento de la secreción de los glucocorticoides internos. Los antidepresivos serían los encargados de restaurar esta homeostasis fallida.
El hipocampo es un nexo entre la cognición y la emoción. La lesión del mismo, en el ser humano, interfiere en los procesos de aprendizaje e interrumpe los procesos atencionales. Los corticoides afectan la excitabilidad de las redes neuronales del hipocampo, donde existe la mayor densidad de receptores glucocorticoideos. Este efecto produciría una inhibición del consumo de glucosa con el resultado de niveles de hipoxia neuronal.
Si someten ratas a situaciones estresantes y se analizan, ya sea por estudios electrofisiológicos o por cortes de cerebro ‘post mortem», se comprueba una disminución del crecimiento de las dendritas de las neuronas piramidales CA3 del hipocampo y que las mismas disminuyen su porcentaje de descargas y sus ramificaciones Por la situación del estrés.
Este modelo se aplica para comparar la eficacia de los antidepresivos. Así por ejemplo, si se compara la clorimipramina con la tianeptina -de reciente aparición en el mercado farmacéutico-, se observa que en las ratas, la tianeptina aumenta el crecimiento de las neuronas piramidales respecto de, las sometidas al estrés y que si se compara la tianeptina con la clorimipramina, la primera aumenta el porcentaje de descargas de las células piramidales, por producir un descenso de los glucocorticoideos aumentados, por el estrés a que fueron sometidas.
Prueba de inhibición a la dexametasona
Los sujetos normales tienen cortisol plasmático elevado por la mañana y bajo por la tarde, en cambio los depresivos mayores lo tienen elevado -de manera permanente- durante todo el día.
La prueba consiste en una determinación basal de cortisol plasmático a las 8 hs.; la administración oral de 1 mg de dexametasona a las 23 hs y el hallazgo de más de 5 microgramos por decilitro, en algunas de las 3 mediciones de las 8, 16 o 23 hs del día siguiente. De las 3 determinaciones, la más sensible es la que se realiza a las 16 hs, por consiguiente se recomienda una única extracción a esa hora, del día siguiente a la toma oral, para evitar molestias de repetidas punciones venosas, que no contribuyen a la sensibilización del Test (20).
La Prueba se denomina «anormal, positiva o supresora», con determinaciones que superen los 5 ug/dl; en tanto que será «normal, negativa o supresora», cuando las mismas estén por debajo de dicha cifra.
La explicación más probable de la positividad de la Prueba es por aumento de la descarga hipofisaria de ACTH, desde las estructuras hipotálamo-límbica (que escapan a la acción inhibitoria de la dexametasona).
En pacientes depresivos mayores, la positividad de la Prueba, predice:
– antes del tratamiento con antidepresivos: una lenta respuesta de la eficacia a los mismos, y
– despues del tratamiento con antidepresivos: una alta probabilidad de recaída en la enfermedad depresiva
La Prueba es positiva en diferentes trastornos psiquiátricos y no psiquiátricos y en el 50 a 95 % de los pacientes con depresión mayor, especialmente en aquellos que presentan melancolía o psicosis.
Cuadro 10. Prueba de la dexametasona positiva en Trastornos Psiquiátricos y No Psiquiátricos
Existe un pequeño grupo de falsos negativos como son las endocrinopatías (en especial la enfermedad de Addisson), y algunos fármacos: las benzodiazepinas (en dosis altas mayores a 25 mg/día), la espironolactona y la ciproheptadina.
Los enfermos con enfermedad de Parkinson, que presentan depresión, tienen el índice más alto de sensibilidad a la prueba (74 %), seguida por la de los que tienen depresión psicótica (50 %), accidentes cerebrovasculares con depresión (50 %) y por la «depresión menor» en un 23 %, Esta sensibilidad aumentada se debería en la senescencia, a las alteraciones estructurales del SNC -en especial en el hipocampo- que producirían un feedback negativo a los glucocorticoides.
Se ha podido comprobar que las alteraciones cerebrovasculares juegan un rol importante en la etiopatogenia de la enfermedad depresiva involutiva, ya que en la tomografía computada y en la resonancia magnética nuclear aparecen los siguientes hallazgos:
1) agrandamiento de los ventrículos; atrofia cerebral; disminución del volumen del caudado, del putamen y del hipocampo;
2) «objetos brillantes no identificados», denominados «UBOS» (unidentified bright objects), hiperintensidades subcorticales, leucoencefalopatías o leucocariosis, presentes en lo profundo de la sustancia blanca, en la zona periventricular y en los ganglios basales donde están la terminación de las pequeñas arteriolas Esta anomalía, se detecta en el 83 % de los pacientes depresivos, entre los 59 y 66 años y en el 100 % de los mayores de 74 años.
Los mecanismos que se atribuyen a la positividad de la Prueba son los siguientes:
1) aumento del metabolismo de la dexametasona,
2) disminución de la sensibilidad de los receptores glucocorticoides a la dexametasona,
3) aumento de la sensibilidad a la estimulación por ACTH,
4) aumento de la descarga hipofisaria desde la estructura hipotálamo-límbica, que sobrepasa a la acción inhibitoria de la dexametasona.
De todas esta hipótesis, el escape del CRH-ACTH a la acción inhibitoria de la dexametasona parece ser el más adecuado.
La Prueba, conjuntamente con el aumento del cortisol, la respuesta aplanada de la ACTH a la estimulación por la CRH y la hipertrofia hipofisariasuprarrenal, son marcadores de estado ya que se normalizan luego de un episodio depresivo, y pueden predecir una recaída o un mal pronóstico, en vez de mantenerse alterados, de manera permanente, como lo harían los marcadores de rasgo de la enfermedad (cuadro 11) (6, 34).
Cuadro 11. Utilidad clínica de la prueba de Inhibición a la Dexametasona (¿marcador de estado?)
1) En los pacientes con trastornos afectivos que no completan los criterios del DSM-IV
2) En los pacientes depresivos con síntomas psicóticos (para diferenciarlos de la esquizofrenia y de las psicosis no afectivas)
3) En la depresión de los adolescentes que presentan síntomas atípicos de depresión (corporales o psíquicos)
4) La positividad del test durante un tratamiento con AD indica
a) mala respuesta al tratamiento
b) alta probabilidad de recaída, aún con el paciente asintomático (la necesidad de continuación del tratamiento con AD)
Psicosis corticoidea
La incidencia de alteraciones psicóticas y confusionales, producida con la terapéutica con corticoides es mayor, que la registrada en la enfermedad de Cushing. Si bien en el Cushing existen alteraciones afectivas (depresión, irritabilidad, ansiedad), alteraciones vegetativas (disminución de la libido, fatiga, insomnio medio y cambios de los hábitos alimentarios) y alteraciones cognitivas (disminución de la concentración y de la memoria), no llegan a ser síntomas graves comparados con la euforia de comienzo, la gravedad de la depresión, los delirios iniciales, la irritabilidad y los déficit congestivos, que pueden aparecer con las dosificaciones elevadas de la terapéutica realizada con corticoides.
En un estudio realizado en 35 pacientes que presentaron enfermedad de Cushing, más del 70 % de los mismos tenían síntomas depresivos con disminución de la libido y fatiga antes de comenzar el tratamiento con corticoides. De este grupo, sólo en el 11 % aparecieron síntomas delirantes y/o estados confusionales.
La secreción diaria de cortisol, en los 35 pacientes, fue de 73 mg/día, lo que equivale a una ingesta aproximada de 20 mg/clía de prednisona. Pero, en los enfermos que presentaron ideas delirantes y/o confusionales el promedio fue de 157 mg/día, equivalente a la toma de 40 mg/día de prednisona.
Los pacientes que reciben dosis altas de corticoides durante años estarían, entonces, más expuestos a desarrollar síntomas psicóticos, que aquellos que usan dosis bajas durante períodos cortos.
El estudio de seguimiento de pacientes tratados con prednisona, efectuado en 1972, tuvo el mérito de haber precisado la incidencia de la aparición de síntomas psicóticos agudos (en especial maníacos y delirantes), en una población tratada con prednisona, carente de antecedentes psiquiátricos previos, y que los mismos aparecieron durante el tratamiento con el corticoide. La investigación pudo determinar que existe una relación directa entre los cambios conductales y las dosis administradas. La aparición de alteraciones psicóticas era menor al 3 %, con dosis inferiores a 41 mg/día; este porcentaje que se incrementaba al 4,6 %, con dosis de 41 a 80 mg/día; y trepaba al 18,4 % en aquellos enfermos que llegaron a recibir más de 80 mg/ día de prednisona.
La mayor frecuencia de la psicosis corticoidea en mujeres se relacionaría con el hecho de que son más frecuentes las enfermedades autoinmunes y el consumo de corticoides en la mujer que en el hombre.
Los síntomas psicóticos que aparecen durante la administración de corticoides, pueden controlarse si se reducen las dosis o si se suspende el fármaco. Sin embargo, se debe tener en cuenta el denominado síndrome de abstinencia a los corticoides. Es preferible la utilización de neurolépticos, aun en el caso que el paciente esté depresivo -hasta lograr disminuir la dosificación del corticoide-, ya que los antidepresivos pueden exacerbar la sintomatología alucinatoria. En los casos de empeoramiento, no se pudo establecer si ello se debió a que los pacientes eran portadores de un trastorno bipolar o de alteraciones tiroideas previas.
La hidrocortisona aumenta los niveles de la enzima triptófano-pirrolasa hepática, con el consiguiente decremento del triptófano y serotonina cerebral. En cultivos de tejidos, la dexametasona, la prednisona y la hidorcortisona estimulan a la tirosina-hidroxilasa (que es la enzima que limita la producción de catecolaminas); esta enzima podría alterar la regulación de la dopamina y de la noradrenalina, así como también los niveles de ACTH, somatostatina y de las P-endorfinas y P-Iipotropinas. Estimula, además, a la acetiltransferasa (que inhibe la síntesis de acetilcolina), alteran la sensibilidad del receptor noradrenérgico-adenilciclasa e interactúan con el GABA.
En pacientes con esclerosis múltiple, que presentaron una historia familiar de desórdenes afectivos o de alcoholismo en primer grado, pudo comprobarse una mayor incidencia de respuestas maníacas, cuando son tratados con corticoides. Ello podría explicarse por la predisposición poligenética en común, que presentan la esclerosis múltiple y los desórdenes afectivos.
En un estudio realizado con material genético, mediante la reacción en cadena de la polimerasa, efectuado en 22 familias con historia de trastorno afectivo bipolar, sobre 365 familiares investigados 165 presentaban el desorden maníaco-depresivo. Los cálculos estadísticos revelaron un fragmento similar en el cromosoma 18 en los parientes enfermos, que no lo presentaban los portadores sanos.
En esta región se encuentran más de 100 genes. Uno de estos genes contiene la información para la formación del receptor ACTH. El otro fragmento de ADN codifica a un gen implicado en la síntesis de las subunidades alfa de la proteína G. Este hallazgo tendría relación con el mecanismo de acción molecular del litio, que bloquea las activaciones enzimáticas, de las cuales la más conocida es la inhibición selectiva de la adenilciclasa-noradrenalina sensible.
Para la movilización del calcio intracelular de los depósitos, es necesaria la activación del inositol trifosfato (ITP-3) y del diacil-glicerol (DAG). Éstos se forman a partir de la hidrolización del fofatidil-inositol-bifosfato, generado por un mecanismo proteína G dependiente, resultado de la unión del receptor con su ligando y consecuente activación de la fosfolipasa G.
Los receptores glucocorticoideos tendrían la misma codificación genética que el inositol. En los enfermos bipolares existe un aumento del inositol y del CRH, por disminución de receptores glucocorticoideos. El litio me ora a los enfermos bipolares, por cuanto se inhibe el sustrato del inositol y consecuentemente el de CRH, razón por la que no tiene acciones sobre individuos normales, quienes no tienen un incremento de los sistemas proteicos de los segundos mensajeros. Este aumento de los glucocorticoides podría tratarse por bloqueadores específicos (ver cap. 7).
Tratamiento de la hipercortisolemia
La hipercortisolemia no aparece en todos los pacientes depresivos y no todos los hipercortisolémicos desarrollan depresión. Aunque podría postularse, que el aumento del cortisol es más específico para determinados síntomas de la depresión como son el insomnio, la pérdida de la libido y la diminución de la energía y la concentración. Se han logrado éxitos, sobre los síntomas depresivos, si se logran disminuir los valores de cortisol.
En un estudio realizado con 29 pacientes que fueron tratados con psicoterapia cognitiva, sin medicación, tuvieron un mayor índice de mejoría -evaluada por la escala de Hamilton-, aquellos pacientes que presentaban una menor secreción de cortisol diario.
La vía directa para tratar la hipercortisolemia de los pacientes antidepresivos es el bloqueo del cortisol. Sin embargo, cualquier tipo de bloqueo por el mecanismo de feedback compensatorio, produce, en las etapas iniciales sobre el eje, un aumento de la producción de ACTH y cortisol hasta que, las dosis bloqueantes impidan este escape, que nuevamente tiende a fracasar a lo largo de los meses de tratamiento, se vuelve a recuperar.
Existen varias vías para efectuar dicho bloqueo, en casos de patología hipofiso-suprarrenal, aunque para ser aplicadas a la depresión, están aún en vías de experimentación.
Las técnicas consisten en evitar la producción de glucocorticoides a nivel adrenal:
– Adrenalectomía quirúrgica o farmacológica
(uso de mitotane, para el cáncer adrenal).
– Bloqueo de la síntesis.
El ketoconazol («Orifungal») se lo usa como agente antimicótico, oral o local de amplio espectro, y a igual que la aminoglutetimida bloquea la formación del cortisol, y de hormonas androgénicas (dehidroepiandrosterona Y androstenediona). Dado que baja los niveles de testosterona se lo ha ensayado también para el tratamiento del hirsutismo femenino y el cáncer de próstata en el hombre. Las dosis necesarias como bloqueantes corticoideos son superiores a las que se usan como agente anticandidiásico. Ha sido utilizado sólo en estudios controlados, dado que debe, vigilarse su administración porque puede disminuir la aldosterona y el cortisol matutino de manera importante.
Los efectos colaterales más comunes incluyen cefaleas, náuseas y fatiga y excepcionalmente hepatotoxicidad.
La metyrapona bloquea la enzima 11-beta hidroxilasa, que convierte el 11 -desoxicortisol en cortisol, lo que ocasiona en tratamientos prolongados, virilización e hirsutismo por el notable aumento de los derivados androgénicos; además de otros trastornos gastrointestinales.
La aminoglutetimida inhibe la conversión de colesterol en pregnenolona. Dado que inhibe la síntesis de estrógenos se lo ha usado asociado con cortisol en el cáncer de mama. El rash cutáneo, la fotofobia y la somnolencia son los efectos más molestos.
– Bloqueo de su acción a nivel del receptor
El mifepristone inhibe la secreción de progesterona y cortisol. En estudios experimentales aparecieron amenorrea y trastornos gastrointestinales.
– la inhibición de la secreción de ACTH
De todos ellos la ciproheptadina es la más conocida dado que por sus acciones antiserotoninérgicas inhibe la ACTH, pero también posee efectos antihistamínicos, anticolinérgicos y antidopaminégicos. Sus efectos colaterales más comunes incluyen la sedación, y los aumentos del apetito y del de peso.
La bromocriptina y el valproato se los ha ensayado con diferentes éxitos.
Es necesario conocer estos adelantos farmacológicos ya que estarnos frente a un nuevo capítulo del tratamiento de la depresión de tipo hipercortisolémico, dado que estos fármacos no sólo disminuyen el cortisol, sino que mejoran la depresión de tipo resistente demostrable por la clínica y las diferentes escalas utilizadas.
Anorexia nerviosa
La anorexia nerviosa produce una estimulación del eje límbico-hipotálamo-hipofiso-suprarrenal, atribuible a la pérdida de peso, la reducción de la ingesta calórica, la selección de los hábitos alimentarios (malnutrición) y a los desórdenes de la ingesta (atracones y vómitos). Ésta implica un incremento del CRH, que tiene un poder anorexígeno, con la consiguiente tolerancia para mantener la abstinencia alimentaria y producir:
a) aumento del cortisol plasmático y urinario,
b) niveles normales de ACTH,
c) una respuesta de la ACTH aplanada en el test de estimulación a la CRH, y
d) una prueba de inhibición a la dexametasona «positiva o no supresora».
La reducción del clearance y la alteración del metabolismo del cortisol prolongan el tiempo de vida media, con la consiguiente:
– Inhibición de la TSH,
– Disminución de la liberación de la T4, y
– Disminución de la producción de la T3. Todo ello contribuye a alterar el metabolismo del cortisol con un aumento en la proporción del tetrahidrocortisol/tetrahidrocortisona.
Recién cuando se restablece el peso, se normaliza el test de estimulación a la CRH, apareciendo tina relación ACTH/cortisol normal.
La prueba de inhibición a la dexametasona no es específica, ya que está influenciada por la pérdida de peso y la disminución de la ingesta calórica. La prueba se normaliza o mejor dicho se «negativiza», citando la ingesta calórica es positiva, es decir que la dexametasona exógena alcanza para bloquear la ACTH N, la CRH y evitar de esta manera el aumento del cortisol.
Síndrome de fatiga crónico
Existen síntomas comunes entre la enfermedad de Addisson y el síndrome de fatiga crónico. El ánimo depresivo, la debilidad muscular progresiva (adinamia) -con mayor fatiga física por la tarde-, la dificultad en la concentración mental, los déficit de la memoria, la falta de apetito, la disminución del peso y los trastornos gastrointestinales, son entre otros comunes a ambos. Sin embargo la depresión atípica, el síndrome de Cushing, el hipotiroidismo y la fase depresiva de la depresión estacional también los presentan. Naturalmente, la fatiga crónica no presenta la hiperpigmentación de piel y mucosas de la enfermedad de Addison, de origen hipotalámico ACTH-dependiente. Por otra parte, el Addison no tiene las laringitis crónicas, con elevación de la temperatura corporal de hasta 38 ‘C, ni los dolores musculares agravados por el ejercicio o el despertar de la fatiga crónica clásica.
Esta sintomatología de la fatiga crónica, con sus exacerbadas respuestas alérgicas y aumento de los títulos de anticuerpos a algunos antígenos virales, podrían reflejar una insuficiencia suprarrenal.
Las infecciones virales incrementan la liberación de citokinas, como por ejemplo la Interleuquina 1 y el factor de necrosis tumoral (FNT, caquectina) y producen una disminución de la respuesta glucocorticoidea y de la CRH, debido a cambios de las estructuras neuronales hipotalámicas, demostrables por estudios experimentales, donde se ha podido observar, que en ratas, aparece destrucción neuronal de la hipófisis anterior por infecciones virales.
Los intentos de tratamientos de la fatiga crónica con antidepresivos, en especial de los de tipo IRSS, han sido mucho más exitosos, que con las interleukinas o con agonistas colinérgicos, que estimulan la síntesis, la CRH.
La CRH está, no solamente presente en el hipotálamo, sino también en el sistema límbico y la amígdala, zonas que habitualmente controlan los afectos y las conductas. Resumiendo, se pudo establecer en el síndrome de fatiga crónico las siguientes alteraciones:
1) disminución de la CRH,
2) cortisol bajo,
3) ACTH vespertino alto,
4) test de ACTH con una respuesta exagerada al cortisol, y
5) test de estimulación de la CRH con respuesta aplanada de la ACTH, similar a la de un patrón depresivo. Por consiguiente, se podría postular al síndrome de fatiga crónica como una insuficiencia suprarrenal leve de origen secundario.
Pánico, fobia social, estrés postraumático
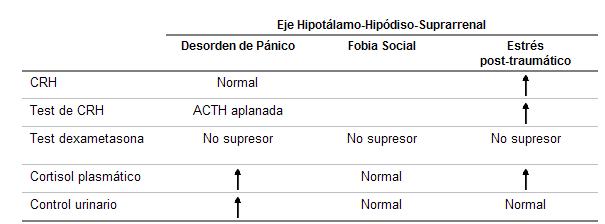
Es probable que el estrés y el pánico no tengan las mismas alteraciones en este eje.
No hay una demostración cabal de la elevación del cortisol urinario de 24 hs., ni de la positividad de la prueba de Inhibición a la dexametasona en panicosos o en fóbicos.
Sin embargo el aumento del cortisol urinario se observa más en pacientes con ansiedad de tipo anticipatoria y en los que han tenido intentos suicidas. Así por ejemplo el nivel de los 17 – hidroxicorticoides urinarios se eleva de manera significativa en los períodos previos a los intentos suicidas.
Cuadro 14. Alteraciones neuroendocrinas en los desórdenes de pánico, fobia social y estrés post-traumático.
2-4. Eje hipotálamo-hipófiso-tiroideo
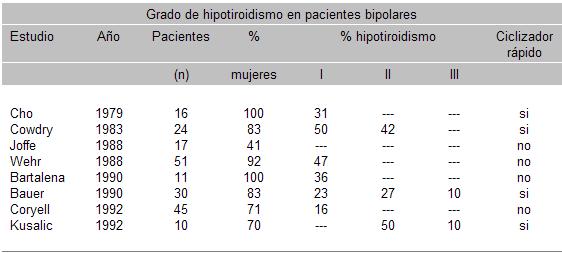
Su estudio es imprescindible en los trastornos maníaco-depresivos, en el desorden de pánico y en la depresión recurrente, así como también en el monitoreo del tratamiento de pacientes medicados con litio.
La glándula tiroides tiene, como función más importante, el almacenaje de iodo para la síntesis, almacenaje y secreción de tiroxina (tetraiodotironina o T4). Esta hormona es fundamental para el desarrollo celular, ya que estimula el consumo de oxígeno, y produce una rápida respuesta calorigénica, que puede impedirse cuando faltan las catecolaminas. Además interviene en los metabolismos proteico, graso, hidrocarbonado y tiene efectos sobre la piel, corazón y otros órganos. Fue necesario en los mamíferos desarrollar esta glándula interna (en los intevertebrados formaba parte del sistema gastrointestinal) para almacenar ioduros, de no tan fácil obtención en la naturaleza como sí lo es la tirosina de los alimentos, ambos compuestos necesarios para la formación de las hormonas tiroideas.
Durante el embarazo y el período neonatal la tiroxina puede atravesar la barrera hematoencefálica del niño, no así la del adulto. Su falta en el feto, impide la formación de la vaina mielínica, produciendo lesiones cerebrales irreversibles, como es el cretinismo. En el adulto, su falta ocasiona retardos, enlentecimiento de los pensamientos, psicosis y paranoias. Su exceso se caracteriza por presentarse con irritabilidad e hipersensibilidad al calor. Puede disminuir el umbral epiléptico, empeorar la enfermedad de Parkinson y precipitar la tiroxicosis con o sin exofaltmos. En la mayoría de los casos se asocia con nerviosismo, hiperhidrosis, taquicardia, temblores y bocio.
La relación del eje hipotálamo – hipófiso – tiroideo con los trastornos afectivos se basa en los siguientes hallazgos:
1 ) Los pacientes, que poseen alteraciones hipotiroideas, presentan frecuentemente síntomas depresivos, y pueden semejar los criterios para depresión mayor.
2) Algunos pacientes con trastornos afectivos presentan anormalidades en este eje.
3) Las hormonas tiroideas se usan para tratar la depresión o potenciar los efectos de los antidepresivos.
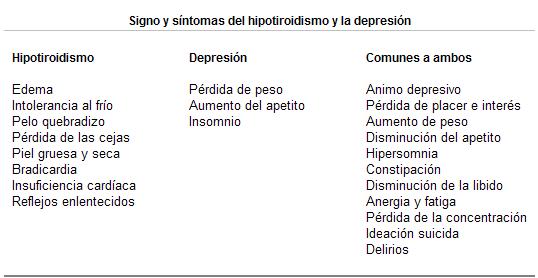
Los síntomas del hipotiroidismo y de la depresión se pueden superponer. Solamente la pérdida de peso, la hiperorexia y el insomnio, son síntomas más característicos de la depresión que del hipotiroidismo.
Cuadro 15. Eje hipotálamo-hipofiso-tiroideo
Cuadro 16. Eje – Hipotálamo – hipófiso – tiroideo
(Tomado de Leibenluft)
Cuadro 17. Eje hipotálamo-hipófiso-tiroideo
TRH (Síntesis y excreción)
Vías aferentes del SNC (Ac, NA, 5-HT, GABA, encefalinas. Inhibida por la somatostatina)
1 Neuronas productoras de TRH (núcleo paraventricular del hipotálamo)
1 Plexo sanguíneo hipotálamo-hipofiscal
1 Plexo sanguíneo portal de la adenohipófisis
1 Receptores a TRH en las células tirotropas de la adenohipófisis
1 Síntesis y excreción de TSH
1 Sistema sanguíneo periférico
1 Receptores a TSH en las células tiroideas
1 Síntesis y excreción de T3 y T4
1 Potenciación de AD (Estimulación beta-adrenérgica)
Por otra parte síntomas del hipotiroidismo como son el edema, la intolerancia al frío, el pelo quebradizo y las alteraciones cognitivas, puede llegar a confundirse con la demencia o la pseudodemencia.
La células productoras de TRH, ubicadas en la región supraventricular del hipotálamo son estimuladas por las vías aferentes del SNC -mediadas por números neurotransmisores, como son la AC, la NA, la 5-HT, el GABA y las encefalinas, e inhibidas por la somatostatina (cuadro 17).
Luego de su excreción, es transportada humoralmente desde el plexo sanguíneo hipotalámico-hipofiseal al portal de la adenohipófisis, donde se une a receptores específicos de las células tirótropas para permitir la síntesis y excreción de la TSH al sistema sanguíneo periférico. La TSH se unirá a los receptores específicos, en las células tiroideas, donde permitirá la síntesis y excreción de la T3 y la T4. Esto último mediado por la adenilciclasa-calcio dependiente (el litio actúa en este nivel y puede impedir esta acción y provocar un hipotiroidismo con aumento consecutivo de la TSH) (cuadro 17).
Esta estimulación, producida por las hormonas tiroideas, permite potenciar el tratamiento antidepresivo debido a que actúa sobre las acciones betaadrenérgicas de los receptores, potenciando así dicha transmisión neuroquímica. Por consiguiente en la depresión resistente, deberá vigilarse durante el tratamiento de potenciación el cambio de fase, ya sea como prevención de un posible trastorno bipolar encubierto, o un pasaje a la manía en un paciente maníaco-depresivo, que ha evolucionado con una depresión resistente.
La secreción de hormona tirotrófica (TSH) depende de la hormona de liberación hipotalámica (TRH) y del feedback negativo de la triiodotironina (T3) y de la tiroxina (T4).
Test de estimulación de la hormona Liberadora de Tirotrofina (TRH)
La secreción de TRH está regulada por la noradrenalina, la dopamina e inhibida por la somatostatina (2, 6, 34).
El test de estimulación de TRH, consiste en administrar 200-500 ug de TRH de manera intravenosa por la mañana, luego de obtenerse el valor basal de Tirotrofina (TSH) del paciente. Posteriormente, se extraen muestras sanguíneas, cada 30 minutos por espacio de 2-3 hs; o se realiza una determinación nocturna, a las 23 hs., y se calculan, las diferencias respecto al valor basal de TSH. La prueba se considera normal, cuando las diferencias son menores a 5-7 uU/ml; disminuida (hiporrespuesta o curva aplanada), cuando son mayores a 5-7 uU/ml; y aumentada con cifras mayores a 15 uU/ml.
De esta manera se pueden diferenciar 2 tipos de respuestas:
1) la del hipertiroidismo precoz y la de la depresión mayor (25-30 %) donde aparece una curva aplanada, y
2) la del hipotiroidismo primario y la de algunos casos de depresión mayor (menos del 15 %), donde los valores de TSH aparecen aumentados. En este último caso, es conveniente investigar la posibilidad de un hipotiroidismo subclínico, debido a tiroidititis asintomáticas (cuadro 18).
El hipertiroidismo raramente se confunde con tina enfermedad psiquiátrica, ya que los diagnósticos diferenciales son la ansiedad y el pánico. Excepcionalmente, el hipertiroidismo puede confundirse con la fase hipomaníaca de un trastorno Bipolar I o II.
La hipersecreción de la hormona liberadora de TSH (TRH) en la depresión mayor, produce una regulación descendente («down regulation») de los receptores a TRH en la hipófisis anterior, lo que ocasiona la hiporrespuesta de la hormona Tirotrófica (TSH). Este aumento de la TRH se pudo compro bar en el LCR de pacientes depresivos. Otras hipótesis, que justifiquen la inhibición de la secreción de la Tirotrófica (TSH), como son la hipercortisolemia o la secreción aumentada de somatostatina, no han podido demostrarse.
Los pacientes hipotiroideos pueden confundirse con depresivos y ser tratados erróneamente con antidepresivos. Entre un 8 y 14 % de pacientes deprimidos tienen hipotiroidismo de grado III, llegando hasta el 20 % en depresiones resistentes, es por ello, que actualmente el eje tiroideo debe ser evaluado de manera rutinaria en los pacientes depresivos y obviamente en forma seriada en los que están medicados con litio (cuadro 19).
Algunos investigadores sostienen que se pueden determinar los niveles sanguíneos de la hormona Tirotrófica (TSH), por el método ultrasensible de radioinmunoanálisis (IRMA, Improvement Radioinmunological Assay), siendo el mismo suficientemente sensible, como para no ser necesaria la prueba de estimulación de la TRH.
Por consiguiente las alteraciones más comunes en este eje en la depresión mayor (cuadro 20) son:
1) Una prueba de estimulación con la Hormona Liberadora de Tirotrofina (TRH) anormal.
2) Una incidencia aumentada de tiroiditis (presencia 4 veces mayor, de anticuerpos antitiroglobulínicos).
3) Un aumento de la TRH en líquido cefalorraquídeo.
4) Una disminución de la Hormona Tirotrófica (TSH) por la noche.
Potenciación del tratamiento antidepresivo con hormonas tiroideas
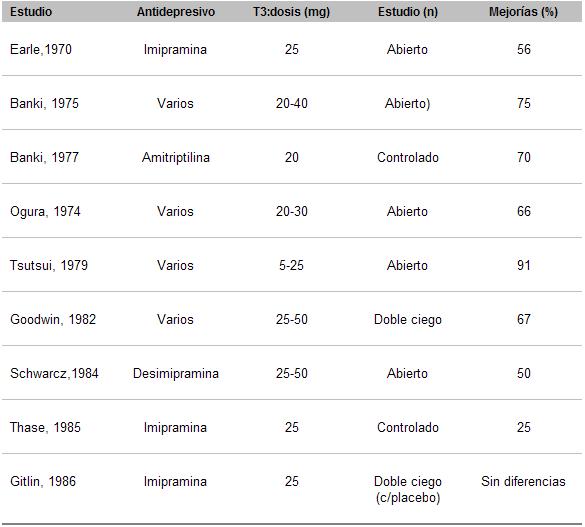
Desde que en 1969, Goodwin y Prange utilizaron la T3 para acelerar la respuesta a la imipramina, numerosos estudios, sobre todo en mujeres, se sucedieron con eficacias terapéuticas diversas, que oscilaron entre el 25 % y 91 %.
Potenciación del tratamiento antidepresivo por Triiodotironina (T3)
El tiempo de tratamiento necesario con hormonas tiroideas, para probar si existe potenciación de los antidepresivos, en pacientes con depresión resistente sin alteraciones tiroideas, oscila entre las 2 y 4 semanas, debiendo realizarse la suspensión de las mismas, de manera paulatina con dosis decrecientes.
La utilización de la sal sódica de la triidotironina (T3), denominada liotironina, en dosis de 25 a 50 microgramos por día, parece ser más efectiva que la de la levotiroxina (T4), usada de 50 a 100 microgramos por día. La T3, sin embargo, puede producir una mayor desinhibición e irritabilidad que la T4.
En el clásico estudio de Joffe en donde se estudiaron 38 pacientes con depresión resistente que no obtuvieron respuestas efectivas con antidepresivos convencionales, los decrementos de los puntajes de la escala de Hamilton fueron significativamente mayores, con T3 (53 %) que con T4 (19 %) (28).
Se cree que podría haber una relación entre anormalidades tiroideas y ciclizadores rápidos, ya que se ha comprobado, que las mismas son de utilidad en el tratamiento del trastorno bipolar con ciclización rápida. No está dilucidado si esta mejoría podría deberse al efecto de la T3 o T4 o a la concomitancia del trastorno con hipotiroidismos subclínicos, no investigados en este tipo de pacientes.
Anorexia nerviosa
El eje tiroideo, y en particular la tiroides, no se alteran por el hambre o la desnutrición. Lo que se produce es tina abrupta disminución periférica de la conversión de Tiroxina (T4) en Triiodotironina (T3), ya que normalmente entre el 80-90 % de la T3, se forma por la desionidización periférica de la T4.
Cuando existe deprivación importante de carbohidratos se forma una T3inactiva, lográndose así una notable baja de] consumo de oxígeno o metabolismo, que remedan a los síntomas hipotiroideos (piel y pelo seco, constipación, bradicardia, intolerancia al frío, hipercolesterolemia e hipercarotininemia).
A diferencia del hipotiroidismo, que aparece con una disminución de la T3 con aumento de la hormona Tirotrófica (TSH), en la anorexia nerviosa los valores de T3, T4 y TSH son normales.
El eutiroidismo permite conservar, como en enfermedades comunes de origen no tiroideo, la masa muscular durante los períodos de hiponutrición de la anorexia nerviosa, por lo que estas alteraciones se han denominado «síndrome de enfermedad eutiroidea «.
No es conveniente en estos casos la administración de T3, pues lo único que se conseguirá será un aumento del catabolismo proteico. En los períodos de mejoría, con ganancia de peso corporal, pueden aparecer picos elevados de T3 y una prueba de estimulación a la Hormona Liberadora de Tirotrofina (TRH) con respuesta aumentada de la Tirotrófica (TSH).
Efectos adversos del litio
El tratamiento con sales de litio en los pacientes tratados por largos períodos de tiempo, puede llegar a ocasionar un ligero bocio, eutiroideo, ya que al impedirse la liberación de la tiroxina por la glándula tiroides, debido a un bloqueo del AMPc-dependiente, se produce un incremento de la liberación de TSH hipofisaria. El litio puede también impedir la captación de iodo por la glándula tiroides y la iodinización periférica de la T3.
Además de la evaluación previa a la instauración del tratamiento con litio, que incluye las determinaciones de T3, T4, T4 libre, TSH y anticuerpos antitiroideos, se recomienda monitorear cada 6 a 12 meses los niveles de TSH de ser posible por el método ultrasensible, a fin de poder detectar hipotiroidismos subclínicos y realizar el tratamiento apropiado con hormonas tiroideas.
Cuando se administra litio, la glándula tiroides, sigue respondiendo, pero con menor intensidad. Sólo en tratamientos de más de 5 a 10 años de duración, se pueden observar alteraciones tiroideas. La alteración más común es la hipersecreción de TSH en mujeres mayores de 40 años. Los valores más altos de TSH los presentan los pacientes bipolares, del tipo ciclizadores rápidos. La corrección del hipotiroidismo no implica un mejoramiento del fenómeno de ciclización.
2-5. Eje hipotálamo-hipófiso-somatotrófico
La hormona de crecimiento está disminuida en mujeres con depresión mayor.
Se ha observado que pacientes adultos, deficientes en Hormona de Crecimiento (HC), (GH, Growth Hormone), presentan una disminución del bienestar psíquico, que llega a afectar su calidad de vida produciendo aislamiento social, inestabilidad emocional y disturbios en su vida sexual, síntomas que son comunes a los observados en la depresión.
La secreción de HC está estimulada por la noradrenalina, la dopamina, la serotonina y es influenciada por otros factores, tales como el estrés, el ejercicio, la hipoglucemia, los estrógenos, los glucocorticoides y las hormonas tiroideas. Por el contrario es inhibida por la acetilcolina, la somatomedina y la somatostatina.
Es difícil responder, si el impacto psicológico que genera la baja estatura -en una sociedad que prefiere a los altos-, altera la regulación hipotalámica por una sobrecarga emocional de sobreexigencia permanente con descargas noradrenérgicas, o por el contrario la deficiencia genética de HC altera la homeostasis psicológica, como es la normalidad en las reacciones de alerta, vigilancia y ansiedad.
En la evaluación de niños normales que habían tenido baja estatura (pero sin historia de desnutrición ni expuestos a traumas psicológicos y/o físicos, en que la HC esta disminuida), se comprobó que los padres habían sido tratados por ansiedad, pánico o fobia social.
En perros pointers alimentados normalmente, pero expuestos «a tareas que producen nerviosismo» en comparación con controles, desarrollaron niveles bajos de HC y la relación entre las mediciones del la masa craneana y el resto del cuerpo estaba disminuida.
En ratas el bloqueo de la HC incrementa la reacción al miedo y disminuye el crecimiento en comparación con los controles.
En un estudio realizado con 10 pacientes, que en su infancia recibieron HC, por déficit de estatura padecieron en su adultez de trastornos de pánico, ansiedad o fobia social. En cambio en niños con ansiedad, a los que se le administró HC por déficit de talla los síntomas de ansiedad y agitación mejoraron, y luego de la suspensión de la de HC empeoraron.
Parece ser, entonces que determinados cambios en la ansiedad están asociados con variaciones de los niveles de HC y que los mismos dependen de la regulación de neurotransmisores a nivel hipotalámico.
Ya es conocido que niños expuestos a traumas psicológicos y/o físicos pueden desarrollar estaturas por debajo del promedio. Similares hallazgos aparecen en niños con severos trastornos de ansiedad. Estos pacientes mejoran la sintomatología luego del tratamiento con HC.
El eje hipotálamo-hipofiso-somatotrófico ha sido estudiado en forma basal y dinámica, y fueron descriptas alteraciones en la respuesta de la HC a la hipoglucemia insulínica, I-dopa, clonidina y otros neuropéptidos hipotalámicos como son las hormonas liberadoras de tirotrofina (TRH), de hormona de crecimiento (GHRH) y de hormona luteinizante (LHRH). Si bien los niveles basales de HC son normales algunos estudios han descripto diferentes alteraciones en el perfil secretorio en 24 hs.
MendIewicz describió la presencia de hipersecreción diurna sin modificaciones en la cantidad de HC secretada durante la noche, mientras que Rubin en 1990 no encontró diferencias significativas en los perfiles secretorios en 24 hs. Otros autores evaluaron solamente el período nocturno coincidiendo en que habría una menor secreción de HC durante este período.
A raíz de estos resultados contradictorios realizamos un estudio que consistió en la medición de la secreción diurna y nocturna de GH en 10 mujeres perimenopáusicas que presentaban depresión mayor según el DSM-IV, todas ellas de peso normal y libres de enfermedades sistémicas y controles en 4 mujeres de igual edad.
Cinco de ellas nunca habían recibido medicación antidepresiva y las cinco restantes fueron estudiadas, luego de un período de 30 días libre de medicación. 8 pacientes fueron catalogadas como unipolares y 2 como bipolares. La edad promedio de las pacientes fue de 50 y la de las controles de 49.5 años.
Para la evaluación de la GH las pacientes ingresaron al laboratorio a las 8 hs. del día en que se realizó la prueba. En una vena superficial del antebrazo se colocó un catéter estéril que se conectó a una bomba de extracción continua para la determinación de concentraciones integradas. Las muestras fueron luego recolectadas cada 30 min. Las pacientes guardaron reposo relativo durante las horas diurnas y su alimentación fue a libre demanda.
Se estudiaron, además de los pulsos de HC, los ejes tiroideo, suprarrenal y el ritmo circadiano de cortisol. La prueba a la dexametasona fue normal en nueve de las 10 pacientes estudiadas. No encontramos diferencias significativas en los niveles de cortisol luego de la prueba de dexametasona entre depresivos y controles, excepto en una paciente que se encontró elevada la TSH, en las demás fue normal.
Las pacientes depresivas secretaron menos HC en 24 hs. que las controles. Al analizar la producción diaria de HC se observa que las pacientes depresivas presentan una disminución estadísticamente significativa de la producción hormonal durante las 24 hs. Este descenso de la HC total, se produjo principalmente a expensas de la HC nocturna, es decir las mediciones de todos los pulsos entre las 22 y 10 de la mañana. La secreción diurna de los pulsos, entre las 10 y 22 hs., también mostró tendencia a la disminución, pero no alcanzó niveles estadísticamente significativos al compararlas con el grupo control. No encontramos, que las pacientes bipolares incluidas en nuestro estudio, presentaran un perfil secretorio que las diferencie del resto del grupo.
Como se observa en los valores individuales de las 10 pacientes los valores son muy inferiores a las de del grupo control.
Se concluye que en las condiciones de esta investigación:
– las pacientes con trastorno depresivo mayor, presentan una disminución de la secreción total de HC, fundamentalmente a expensas del período nocturno.
– Y que la modificación del patrón secretorio, podría deberse a cambios en los neurotransmisores que se encontrarían involucrados en la depresión, como son la adrenalina y serotonina, que son estimulantes de la secreción de HC.
Prueba de la clonidina
De las pruebas psiconeuroendocrinológicas, que se han intentado realizar para conocer el estado funcional de los receptores en el eje hipotálamohipofiso-somatotrófico, se destaca netamente la de la estimulación con clonidina, con la medición de la hormona de crecimiento antes y después de la misma.
La respuesta de la HC a la estimulación por clonidina es un índice indirecto de la actividad del receptor alfa 2-adrenérgico del sistema de neurotransmisión catelcolaminérgico del hipotálamo.
La ansiedad incrementa los disparos de noradrenalina (NA) del locus coeruleus, que localizado en la protuberancia controla con sus fibras aferentes la corteza cerebral, el sistema límbico, el hipotálamo, el cerebelo y la médula espinal. En condiciones normales, el descenso de los niveles de NA está asociado al aumento de los receptores alfa 2. Por el contrario, un aumento de los niveles de NA disminuirá la cantidad de los receptores alfa 2.
La estimulación permanente que realiza la NA, a nivel del hipotálamo, en las condiciones de pánico o depresión, produce una regulación descendente («down regulation») con disminución de los receptores alfa 2 postsinápticos.
Cuando se estimulan los receptores con un agonista, como es la clonidina, en dosis de 2 (g/kg. por vía IV (alrededor de 150 (g en alrededor de 10 minutos), a pacientes con depresión o pánico, habrá menor cantidad de receptores disponibles para ser estimulados, de esta manera se excreta menor cantidad de hormona liberadora de HC hipotalámica, por consiguiente la adenohipófisis liberará una menor cantidad de Hormona de Crecimiento. Se dice entonces que existe una hiporrespuesta o un aplanaminento de la curva de HC. El valor máximo de HC aparece entre los 30 y 60 minutos, y se considera una hiporrespuesta cuando el pico es inferior a 5 mg/ml.
El modelo del pánico será similar al de la depresión: un aumento de los niveles de NA con un descenso de los receptores alfa 2. La prueba no es totalmente específica, ya que aparece también aplanada en el desorden de pánico, en algunos casos de fobia social y en el trastorno obsesivo-compulsivo.
La característica de persistir alterada la respuesta, a pesar de la mejoría de la depresión, la convierte en un «marcador de vulnerabilidad». En cambio, la prueba de inhibición a la dexametasona, aparece como un «marcador de estado», ya que se normaliza con la mejoría de los síntomas depresivos.
Existe una relación directa entre la HC y la ACTH, a través del estrés que presentan los individuos a partir del nacimiento. Los valores disminuidos de la HC predisponen a los trastornos por ansiedad
Habría que realizar la prueba de la clonidina en pacientes que presenten vergüenza, rubicundez, hipersudoración, o mutismo selectivo, ya que estos síntomas podrían interpretarse como grados leves de fobia social o de pánico.
Una respuesta normal de HC, a la estimulación por clonidina, de un paciente depresivo constituye un buen índice de elección de un antidepresivo de tipo inhibidor de la recaptación serotoninérgica (ej. IRSS), en tanto que una respuesta anormal de la prueba no indica la elección de una antidepresivo inhibidor de la recaptación noradrenérgica (ej.: desimipramina).
Se ha observado aumento de HC luego de la administración de desimipramina en sujetos normales. Ello se puede atribuir al mejoramiento de la transmisión noradrenérgica. Con el tratamiento antidepresivo se permitiría la normalización de la respuesta de la HC, debido la sensibilización del receptor alfa 2-adrenérgico.
Anorexia Nerviosa
La desnutrición y el hambre estimulan la liberación de la FH, que se normaliza rápidamente con la ingesta de carbohidratos. La presencia de niveles elevados de HC y cortisol, diferencian la anorexia nerviosa del hipopituitarismo, ya que en este último ambos están disminuidos.
Con la administración de glucosa, se puede observar ¡ni aumento paradojal de HC y de TRH. En realidad éstos son mecanismos de contrarregulación de neoglucogénesis, frente al peligro que entraña la hipoglucemia por desnutrición. Por otra parte la HC y la somatomedina estimulan la movilización de los ácidos grasos en forma sinérgica con los esteroides sexuales en la pubertad.
Resumiendo, las alteraciones que presenta en la depresión mayor en el eje hipotálamo-somatotrófico son las siguientes:
1) Disminución de los pulsos nocturnos de HC
2) Aumento de los pulsos diurnos de HC
3) Hiporrespuesta de la HC, a la estimulación por clonidina
4) Disminución de la Somatostatina en LCR
5) Hiporrespuesta de la HC, a la estimulación por hormona liberadora de HC
2-6- Eje hipotálamo-hipófiso-gonadal
Hay una estrecha relación entre el eje con los trastornos premenstruales y de la alimentación, ya que ambos mejoran con la administración de antidepresivos.
Anorexia nerviosa (para tratamiento ver cap. 10)
Para lograr una eclosión menstrual adecuada en la pubertad es necesario un tejido adiposo y nutrición adecuadas. La amenorrea secundaria en las mujeres y la impotencia en los hombres es considerada dentro del diagnóstico de la anorexia nerviosa. La amenorrea está asociada a una marcada reducción de los niveles de estradiol y a la ausencia de progesterona plasmática.
La secreción de LH cambia su patrón de liberación, según sea la pérdida de peso. Cuando se llega a perder el 45 % del peso corporal, los pulsos de la hormona luteinizante pasan a ser continuos -del tipo puberal o prepuberal en lugar de los habituales pulsos diurnos y nocturnos de la mujer adulta. La respuesta a la estimulación por LHRH es de tipo aplanada para la LH y FSH, demostrando así el origen hipotalámico o suprahipotalámico de la anorexia.
La disminución del estradiol se asocia a una disminución del calcio óseo, con una desviación del estradiol a estrona en lugar de estriol. La 2 hidroxiestrona (que aparece también en el hipotiroidismo) produce:
a) una ligazón a los receptores estrogénicos, pero sin ejercer la función biológica del estriol;
b) inhibe la tirosina-hidroxilasa y la catecol-co-metil-transferasa (COMT) que son de fundamental importancia en el proceso de neurotransmisión noradrenérgica.
Recién cuando se logra recuperar el 70 % del peso corporal, se observan picos de LH por arriba de lo normal, con la estimulación de las hormonas liberadoras gonadotróficas (a semejanza de lo que ocurre durante la pubertad).
Cuando se logra restituir en un 80-90 % el peso corporal, se obtiene un patrón de respuesta adecuada y deberán pasar aun años, hasta conseguir una normalización de los períodos menstruales.
Dado que la administración de naloxano, que es un bloqueante de endorfinas, permite restablecer los pulsos de LH, se presume que la hipoactividad LHRH se debe en realidad a una hiperactividad de los sistemas endorfínicos, los cuales son potenciados por la melatonina, ya que alimenta su secreción diurna y nocturna.
Síndrome de tensión premenstrual (trastorno disfórico premenstrual)
El síndrome de tensión premenstrual es un trastorno caracterizado por un conjunto de síntomas emocionales, conductales y somáticos, que aparecen sobre la terminación de la fase lútea del ciclo menstrual y desaparecen después del comienzo de la menstruación. Es necesario que la fase folicular no presente síntomas para poder hacer el diagnóstico.
El DSM-IV diferencia el «síndrome de tensión premenstrual» [exacerbado por un trastorno mental, o por una enfermedad médica asociada (hipotiroidismo, cáncer, etc.) del «trastorno disfórico premenstrual», en base a la gravedad sintomática y a la incapacidad mayor de este último, ya que ambos comparten los mismos criterios diagnósticos, denominándose «disforia» a un estado de ánimo desagradable (con tristeza, ansiedad o irritabilidad).
Por ahora, las mujeres que completan los criterios diagnósticos del «trastorno disfórico premenstrual» se catalogan como un «trastorno depresivo no especificado», lo cual significa un listado sintomático incompleto de los criterios para el «episodio depresivo mayor» del DSM-IV, ya que el comité de expertos afirma que » [ … ] todavía no se dispone de suficiente información, como para avalar la inclusión de la propuesta como categoría oficial o eje del DSM-IV.
Si bien es cierto, que aún no se puede afirmar, que el trastorno se deba específicamente a un disbalance endocrinológico puro, lo cierto es que el mismo Manual informa que el 75 % de las mujeres describen cambios emocionales durante el período premenstrual, que el síndrome abarca entre el 20 y el 50 % de la población normal (promedio: mujeres de 30 años) y que de un 3 a un 5 % cumplen con los criterios para el «trastorno disfórico premenstrual».
El estado de ánimo depresivo, la letargia con hipersomnia y los cambios del apetito (en especial, los atracones, con afinidad por los glúcidos) ponen a este trastorno muy cerca de la «depresión atípica «, aunque se exige que los síntomas afectivos deben ser acompañados por alteraciones somáticas (tensión mamaria, cefalea, edema de extremidades, etc.) y presentarse, de manera regular, durante varios períodos menstruales, con el comienzo en la fase lútea y desaparición después del inicio de la menstruación (ver cap. 17, 17-2).
La supresión de la ovulación produce alivio de los síntomas premenstruales ya que si se administra un análogo de la hormona LHRH, como es el leuprolide, que suprime el cielo ovulatorio, las pacientes que no presentaron menstruaciones por el bloqueo el ciclo ovulatorio, mejoraron los síntomas de sofocones, turgencia mamaria, depresión, ansiedad y nerviosismo, en cambio en las que presentaban depresión mayor, no hubo alivio sintomático. Ello demostraría que en las pacientes depresivas mayores la tensión premenstrual no depende del componente estrogénico, ya que el bloqueo de la LHRH no impide que persistan los síntomas de la tensión premenstrual, a diferencia del grupo control con tensión premenstrual que sí se alivia con el bloqueo de la LHRH.
Se han ensayado numerosos tratamientos; de todos ellos, los más documentados son los que abarcan drogas para la supresión de la ovulación (estrógenos, progestágenos, análogos de LHRH) y psicofármacos para ser usados durante todo el ciclo (antidepresivos, alprazolam, buspirona). De los antidepresivos usados con mayor éxito se destacan los IRSS (ver cap. 17, 17-3).
2-7. Efectos neuroendócrinos por la administración de psicofármacos
Es importante el control de los efectos secundarios producidos por los psicofármacos sobres los ejes endocrinos, dado que su administración, en la mayoría de los casos, no implica la suspensión, sino el control adecuado de los mismos.
Antipsicóticos
El efecto más comúnmente observado durante el tratamiento con neurolépticos es el aumento de la excreción de la prolactina hipofisaria, debido a que la dopamina, al ser bloqueada por el antipsicótico, no puede producir la inhibición tónica que realiza sobre la hormona. Participan de este bloqueo los sistemas:
a) el nigroestriado, que produce los síntomas extrapiramidales,
b) el mesocorIticolímbico, que con sus proyecciones al núcleo accumbes y a la corteza regula el ánimo, los impulsos y las funciones cognitivas, y
c) el túbero-infundibular, que actúa sobre el hipotálamo y la hipófisis.
Además disminuyen los niveles de las hormonas Luteinizante y de la Folículo-estimulante, con la consiguiente producción de amenorrea en las mujeres e inhibición del orgasmo en ambos sexos.
Los grupos fenotiazínico, butirofenónico y benzamídico bloquean el receptor dopamínico con mayor intensidad que el grupo dibenzodiazepínicos (cuyo exponente es la clozapina) y el de los antidepresivos tricíclicos. (ver capítulo 5)
Cuadro 28. Efectos neuroendocrinos por psicofármacos
Tradicionalmente se concibe al receptor D2 como ubicado en el nivel postsináptico, dado que los fármacos antiparkinsonianos de reconocida eficacia terapéutica (agonistas dopaminérgicos) tienen todos una acción agonista D2, pudiendo combinar tanto un efecto agonista como antagonista sobre el receptor DI.
Se desprende de todo esto que existe una estrecha relación entre el perfil farmacológico in vitro de los distintos agonistas y su efecto sobre la actividad motora extrapiramidal. Esta diferente respuesta estaría condicionada por la relación entre la capacidad agonista o antagonista DI y el efecto estimulador del receptor D2. Un adecuado equilibrio entre estos diferentes efectos sería fundamental para lograr una respuesta terapéutica cercana a la fisiológica.
Por último, y como perspectiva futura, se vislumbra a corto plazo la posibilidad de utilizar agonistas selectivos DI o D2 e intervenir, mediante el uso de análogos peptídicos sintéticos (colecistoquinina), en la modulación de la actividad dopaminérgica en el nivel sináptico.
Los neurolépticos inhiben otros NT, en especial la noradrenalina (NA), la serotonina (ST) y la colecistoquinina (que es un mediador existente en todas las terminales dopaminérgicas).
No hay demostración de que el tratamiento crónico con neurolépticos pueda provocar cáncer de mama o adenomas hipofisarios lactotropos. Cifras de prolactinemia de 3 dígitos tendrán que ser observadas para descartar la presencia de hipertrofias o adenomas prolactínicos.
Las hiperprolactinemias prolongadas pueden producir osteoporosis, por lo que se deberá evaluar, en las mujeres menopáusicas la administración combinada de estrógenos, calcio y vitamina D.
El efecto antipsicótico crónico depende del bloqueo de la DA en el sistema límbico. La elevación crónica de la prolactina (en especial en la mujeres), con antipsicóticos comunes o los de acción prolongada, provocan un aumento del turn-over de DA en las neuronas túbero-infundibulares, luego de 12 a 24 horas de haberse producido las elevaciones de la prolactina sérica.
Existe un nivel de tolerancia muy amplio para los efectos extrapiramidales y el aumento de la prolactina dependen de la dosis, sexo, duración y forma de administración de los antipsicóticos usados. La respuesta de prolactina a la TRH fue normal en pacientes que recibieron neurolépticos durante 5 a 25 años.
Resumiendo, la determinación de prolactina es útil:
1) para diferenciar los antipsicóticos típicos de los atípicos (éstos no aumentan la prolactina),
2) para predecir el tipo de respuesta con una dosis única de antipsicóticos,
3) para correlacionar los niveles plasmáticos de antipsicóticos durante su administración crónica.
Agonistas dopaminérgicos
Para que el neuroléptico ejerza su acción es necesario que atraviese la barrera hematoencefálica. La domperidona, usada como antiemético, es un bloqueador dopaminérgico periférico, por lo tanto no tiene acción sobre la prolactina. Es importante conocer estas diferencias, ya que existen en el mercado farmacéutico numerosas combinaciones con neurolépticos y domperidona, que pueden actuar sobre la prolactina.
Los pacientes con hiperprolactinemia, y que igualmente necesitan ser medicados con antipsicóticos, deberá evaluarse corregirla, siempre y cuando los síntomas de la misma sean molestos e interfieran con la vida habitual del paciente.
La levodopa es un precursor de la dopamina. Seguramente también produce noradrenalina, ya que luego de su administración aumentan los niveles de HVA y de MOPEG. La levodopa es capaz de desencadenar episodios maníacos en enfermos con depresiones de tipo bipolar, así como crisis psicóticas con alucinaciones, descritas en los pacientes con enfermedad de Parkinson. El paciente «convive» con las alucinaciones -ya que la administración de levodopa es de por vida-, en general con poca angustia y buena distancia afectiva de ellas. A veces es necesario continuar su administración; entonces será imprescindible el empleo de antipsicóticos (clozapina). La levodopa no produce efectos antidepresivos útiles, y puede tener, según algunos autores, un efecto sobre el retraso psicomotor en pacientes con ácido homovanílico disminuido.
La bromocriptina fue el primer agonista que se utilizó como inhibidor de la secreción de prolactina. Partiendo de la hipótesis de que involucra a la dopamina en la enfermedad bipolar, se la ha ensayado en dosis de 2,5 a 10 mg/día también en las depresiones bipolares. Los resultados han sido contradictorios, y una revisión reciente de la literatura al respecto, sigue consignando que la utilidad antidepresiva de la bromocriptina debe ser aún demostrada. Se debe comenzar con dosis bajas de 1,25 mg/d de bromocriptina y los incrementos semanales deben ser de alrededor de 1,25 mg/día.
El pergolide tiene una mayor vida media plasmática (de 15 a 40 hs.), en comparación con la de la bromocriptina que es de 6 hs. y del lisuride que es de 2 hs.
Para su administración se debe tener en cuenta la vida media y los efectos adversos como son las náuseas, vómitos y la hipotensión ortostática. La somnolencia es mayor con el lisuride y la probabilidad de extrasistolias ventriculares están descritas con el pergolide (ver cap. 19, 19-7)
Resumiendo, la determinación de prolactina es útil*
1) para diferenciar los antipsicóticos típicos de los atípicos (éstos no aumentan la prolactina),
2) para predecir el tipo de respuesta con una dosis única de antipsicóticos,
3) para correlacionar los niveles plasmáticos de antipsicóticos durante su administración crónica.
Antidepresivos
Casi todos ellos alteran los niveles basales de prolactina, hormona de crecimiento y cortisol ya que actúan sobre mecanismos serotoninérgicos, noradrenérgicos, histaminérgicos y dopaminérgicos de manera preferencial, por lo cual el tratamiento prolongado pueden alterar algunas de las respuestas hipotálamo-hipofisarias.
Los antidepresivos heterocíclicos pueden en forma aguda aumentar los niveles de prolactina en sujetos normales y en pacientes depresivos.
La cloimipramina es 5 a 10 veces más potente que la desimipramina. Este efecto más potente sobre la prolactina se debería al mecanismo inhibitorio sobre la recaptación intersináptica de serotonina. Por el contrario el aumento de serotonina produce hiperprolactinemia.
El triptófano produce hiperprolactinemia por este último mecanismo. Por el contrario, el trazodone, de acción predominante antiscrotoninérgica, disminuye los niveles de prolactina.
El bupropion (Wellbutrin, EE.UU.), libera DA de las células túbero-infundibulares, inhibiendo así la secreción de prolactina y de esta forma sostiene, su tan bien propogandeada carencia de efectos adversos en la esfera sexual (aunque se recomienda su uso con precaución ya que dosis altas pueden disminuir el umbral epiléptico).
Los antidepresivos administrados de forma crónica, pueden aumentar los niveles de prolactina, pero nunca llegar a los niveles que lo hacen los neurolépticos.
Los IMAO elevan la prolactina en el humano y la inhiben en las ratas.
Disfunciones sexuales por antidepresivos
Los nuevos antidepresivos trajeron gran alivio sintomático, al no presentar los molestos efectos adversos anticolinérgicos de los antiguos tricíclicos, pero lamentablemente, los IRSS en especial presentan efectos secundarios sobre la sexualidad, especialmente trastornos del orgasmo y de la eyaculación, que recién se evidenciaron con su uso en el transcurso de¡ tiempo. Así, por ejemplo, el prospecto original de la fluoxetina presentaba alrededor del 8 %, en comparación con placebo. Hoy esta cifra trepa al 36 % de disfunciones sexuales en dosis terapéuticas y seguramente el porcentaje se eleva aún más, en pacientes de edad y con medicaciones o enfermedades asociadas.
Sin embargo ya era conocido este efecto de los inhibidores de la recaptación serotoninérgica, ya que en 1987 en un estudio con cloimipramina en pacientes obsesivo-compulsivos, se describe que, el 96 % de los pacientes presentaron alguna alteración en el área sexual.
Se desconoce la incidencia exacta de los trastornos sexuales por antidepresivos, a pesar de ser una realidad clínica de reconocimiento relativamente frecuente. Su reconocimiento es importante si se quiere mejorar la adherencia al régimen terapéutico. Esto es crítico para personalidades paranoides o bien en personas susceptibles a este tipo de efectos. Se han comunicado variadas alteraciones sexuales: disminución de la libido, dificultades en la erección, anorgasmia y retardo de la eyaculación, entre las más frecuentes. También pocos casos de anestesia peniana, eyaculación dolorosa y hasta orgasmos espontáneos o aumento de la sexualidad. Se sabe que las funciones adrenérgica y dopaminérgica resultan esenciales para la erección, y que el sistema alfa I-adrenérgico es mediador de la eyaculación así como el serotoninérgico inhibitorio, pero las interrelaciones son múltiples, complejas y poco conocidas.
Se tiene noción de que un fármaco dopaminérgico, el bupropión, no se asocia a quejas de disfunciones sexuales, así como también el nefazodone (Serzoneo, EE.UU.) La anorgasmia sería más común con serotoninérgicos y las dificultades en la erección con anticolinérgicos o noradrenérgicos, apareciendo priapismo con trazodone.
Corno antídotos se han ensayado varios fármacos con éxito relativo, todos ellos en condiciones no ciegas. Los fármacos colinérgicos, como la neostigmina y el betanecol, sólo ocasionalmente han resultado útiles en disfunciones de la erección.
La ciproheptadina, antagonista serotoninérgico e histamínico-1, revirtió anorgasmias en pacientes que tomaban fluoxetina, imipramina, nortriptilina, fenelzina y otros. Se utiliza en dosis de 4 a 12 mg una hora y media antes de la relación sexual. También se obtuvieron éxitos con yohimbina en la disminución de la libido inducida por fluoxetina o clorimipramina, ilustrando la complejidad del mecanismo.
La amantadina -agonista dopaminérgico- ha mostrado asimismo alguna utilidad.
Sin embargo estas alteraciones no dependen exclusivamente de las hormonas en juego, sino más bien de los neurotransmisores involucrados.
Hormona antidiurética (HAD) (Arginina-Vasopresina)
Las células que producen HAD se encuentran en el hipotálamo y su neurosecreción es transportada, a través de la eminencia media del lóbulo posterior de la hipófisis.
Su regulación depende de los osmorreceptores del órgano vascular de la lámina terminal subfórnica y subcomisural, que están continuamente censando la osmolaridad del líquido cefalorraquídeo, que refleja el estado de hidratación del organismo.
En caso de hiperosmolaridad, la HAD aumenta, para poder reabsorber más agua por el riñón y mejorar la concentración sanguínea de sales.
Los fármacos que afectan su secreción son la carbamazepina, las fenotiazinas, los IMAO, los barbitúricos y los opiáceos.
En cambio el litio (en forma similar al sodio), puede actuar en diferentes formas:
1) disminuyendo la sensibilidad del riñón a la HAD por inhibición de la adenilciclasa tubular renal,
2) produciendo tina diabetes insípida de causa nefrogénica,
3) aumentando la aldosterona y la renina, no pudiéndose descartar una acción central inhibitoria sobre la HAD.
Los síntomas que produce este exceso de excreción son la retención de agua, la bioponatremia y las alteraciones cognitivas concomitantes siendo el tratamiento la deprivación de agua.
2-8. Psiconeuroinmunooncología
La ayuda psicofarmacológica deberá integrarse a un plan terapéutico global del paciente oncológico, ya que deberá ayudar al mejoramiento de la calidad de vida, a través de la psicoterapia y del tratamiento específico, para no interactuar, a nivel neuroquímico, con factores de la proliferación o mutación celular.
El concepto de comunicación bidireccional establece que las modificaciones en el estado de la mente inducirían cambios neurobiológicos en el cerebro y a su vez estos cambios generarían múltiples alteraciones en el sistema inmunitario. E inversamente las modificaciones o alteraciones del sistema inmune afectarían al SNC, cerrándose así el arco de la comunicación bidireccional (psiconeuroendocrinoinmunología).
Frecuentemente se sostiene que el estrés estaría relacionado con el ulterior aumento de la posibilidad de desarrollos neoplásicos. Sin embargo esta hipótesis, fuertemente sostenida tanto a nivel de divulgación popular como científica, no pudo aún ser demostrada fehacientemente.
Durante los últimos veinte años se han publicado numerosos trabajos que sostienen que el estrés podría ser casi directamente asociado al desarrollo de enfermedades tumorales. Una revisión adecuada y exhaustiva de los mismos ha demostrado fallas metodológicas graves que invalidan su resultado. Algunos de ellas son: falta de grupos controles, adecuados seguimientos clínicos, escasos números de sujetos investigados, escasos entrecruzamientos de relaciones causales, pseudo ponderaciones estadísticas, tomadas como resultados significativos, etc.
Sin embargo, si se quiere hablar de estrés y cáncer habría que establecer un muy adecuado criterio de descripción para evaluar qué tipo de estímulo estresante podría relacionarse con una modificación de las células NK (natural killers), de los linfocitos T, de los linfocitos T-helpers con la producción tumoral.
Es conocido que las fibras simpáticas originadas en el SNC inervan directamente órganos linfoideos como el bazo, el timo y la médula ósea.
La respuesta linfocitaria defensiva no depende sólo del antígeno sino de la respuesta inmunitaria mediada por moléculas como las citoquinas y de cambios conductuales que altera el eje neuroendocrino con la activación de los ejes hipofiso-córtico-suprarrenal, tirotrófico, prolactínico, etc.
Las células del sistema inmunitario (SI) contienen en su superficie un conjunto de receptores especializados para diferentes neurotransmisores, neurohormonas y neuropéptidos, producen mensajeros químicos llamados citoquinas (monoquinas; interferón; interleuquinas 1,2, etc.). Ello es necesario para poder reconocer lo que es propio, de lo que no lo es.
Este tipo de acción está mediada por los linfocitos B y T, que tienen receptores proteicos de reconocimiento ligados a la superficie o membrana celular: los linfocitos B que producen un respuesta inmunitaria de tipo humoral con la secreción de las inmunoglobulinas (IgA, IgD, IgM, etc.) y los linfocitos T (que nacen en la médula ósea y completan su desarrollo en el timo) son los encargados de interactuar con los macrófagos y reconocer sustancias antigénicas para inducir la producción de la interleuquina-1 y actuando sobre la subpoblación de los linfocitos Thelper o CD4+ inducen la producción de otras citoquinas (interleuquina-2, 4; y-interferón) que activan la proliferación de linfocitos T ya que los T-helpers no tienen capacidad de destrucción antigénica.
Las lesiones en la región hipotalámica anterior, inducen un decremento de las respuestas inmunológicas caracterizada por la disminución de la proliferación de linfocitos T y de los NK, por lo que se puede afirmar que este tipo de acciones podrían estar mediadas por los neuropéptidos originados en esta región.
La interleuquina-1 (IL-I), produce fiebre por acción directa sobre el hipotálamo (efecto secundario frecuente en pacientes oncológicos que reciben quimioterapia con interleuquina); liberación de hormona liberadora de corticotrofina (CRH) y acciones sobre la citoarquitectura del sueño.
La interleuquina II (IL-2) produce como respuesta autócrina, a la señal de calcio y proteinoquinasa, la mitogénesis de los linfocitos T y NK determinando de esta forma una respuesta proliferativa específica. También se especula que el AMP cíclico desempeñaría un papel de segundo mensajero en la IIL-2 en estrecha relación con las acciones en el SNC.
Los estímulos psicológicos actúan directamente sobre el SNC, a través de la vía hipotalámica, de las modificaciones hormonales, de los neurotransmisores y de los inmunoneuropéptidos (llamados así porque también los producen las células del SI) y modifican la capacidad/ calidad de la respuesta del sistema inmunitario frente a un agente agresor. El concepto de comunicación bidireccional se explicaría por este tipo de acciones combinadas y directas de las citoquinas sobre el SNC.
Acciones de los neurotransmisores sobre el sistema inmunitario
En relación a los neurotransmisores, se han encontrado receptores beta-2 adrenérgicos en linfocitos B, T-helpers y en T-supresores, en macrófagos y en neutrófilos. Debido a esta gran cantidad de receptores adrenérgicos las catecolaminas actuarían como reguladores del SI, en tanto que las citoquinas y otros neurotransmisores lo harían sobre el segundo mensajero como es el AMPc
Si bien hacen falta más estudios, se presume que fármacos que actúen sobre la inhibición de recaptación de noradrenalina, podrían relacionarse con la producción de anticuerpos.
Un estudio en humanos demostró que la inyección de noradrenalina, produjo un transitorio incremento en la circulación sanguínea de linfocitos, monocitos y un decremento en la proliferación de células T, CD4+ y T-helpers. Las diferentes respuestas que se obtienen a la estimulación de noradrenalina, dependen del tipo de célula inmune y de la sensibilidad de su receptor, pudiendo entonces caracterizarse por un aumento o inhibición de la reacción inmunológica.
El fosfatidil-inositol (IP), que induce a la hidrólisis para la formación de inositol trifosfato (IP3), que a su vez incrementan los valores de calcio y de diacilglicerol (DAG) cumpliría un papel muy importante en la activación de linfocitos B y T, por vía de receptores propios para antígenos.
La serotonina puede estimular o inhibir al SI. Existen estudios que demuestran que la serotonina aumenta la mitogénesis por estimulación, mientras que otros trabajos afirman un decremento de los anticuerpos. Tal vez lo más interesante, es volver a destacar que la serotonina tiene efectos positivos y negativos sobre la reacción inmunológica.
Existen investigaciones donde se comprobó un feedback negativo, entre las concentraciones de interferón y serotonina: la fagocitosis, que depende de la serotonina, aumenta a concentraciones menores que a mayores de interferón. El aumento de serotonina endógena puede disminuir la síntesis de interferón
Acciones del sistema endocrino sobre el sistema inmunitario
La hormona liberadora de corticotrofina (CRH) se produce por neurosecreción en el núcleo paraventricular del hipotálamo, en la corteza cerebral y en tejidos periféricos. La interleuquina-1 produce liberación de CRH, cuyo objetivo inmediato sería la inmunosupresión a un nivel fisiológico. Durante el estrés, con el aumento del cortisol plasmático se corre el riesgo de suprimir en forma indefinida los mecanismos de defensa.
La inyección intraventricular de CRH produce una elevación periférica de las catecolaminas dando por resultado un decremento en la actividad de los NK (de gran importancia en su antagonismo contra el factor de crecimiento tumoral).
Los corticoesteroides se asocian al aumento del estrés. Desde el punto de vista inmunológico, están relacionados con el SI, tanto con la inmunosupresión (disminuyendo las respuestas), como con la estimulación del sistema, por tener un efecto directo sobre la secreción de inmunoglobulinas.
Mientras algunos estudios demuestran efectos inhibitorios de los corticoesteroides sobre la IL-1, otros indican que la administración de glucocorticoides serían nocivos para el sistema inmunológico, ya que reducirían el número de linfocitos en el timo, en el bazo y en la sangre periférica. Asimismo concentraciones elevadas de glucocorticoides, inducirían a la muerte celular de los linfocitos T.
Es conocido que los glucocorticoides en dosis terapéuticas altas producen inmunosupresión, mientras que en niveles fisiológicos, inmunoestimulación.
Otros estudios señalan que la ACTH puede disminuir la expresión de los linfocitos, la producción de anticuerpos, alterar la función de los linfocitos B y la producción de interferón, sugiriendo esto un factor complejo para la actividad antitumoral.
En relación a los inmunoneuropéptidos, existe sustancia P, calcitonina, neuropéptidos Y, colecistoquinina, neurotensina (sustancias normalmente contenidas en las neuronas), en el tejido linfoide de muchas especies, incluido el hombre.
La sustancia P, cuyo desorden metabólico a nivel neurobiológico, está relacionado con diferentes enfermedades psiquiátricas, participa como mediador en la liberación de las «mast-cell» en los procesos de inflamación.
En relación a la hormona de crecimiento, se ha visto que las alteraciones de la misma, podrían determinar una disminución de la reacción inmunológica. Se observó que la hipofisectomía disminuye la respuesta inmune en animales y que la estimulación posterior con hormona de crecimiento y prolactina, aumenta la reacción de la proliferación de las células así como también de la producción de IL-2, medida por el test de estimulación a la sustancia mitogénica concavalina-A.
Concomitantemente con el mejoramiento de la hormona de crecimiento, se produce un aumento de la generación y actividad de linfocitos T, y macrófagos productores de interferón-y.
La prolactina, ha sido identificada en macrófagos y en linfocitos B y T. La inhibición de la secreción de prolactina por parte de la hipófisis, produce un efecto de disminución de la respuesta inmunológica. El tratamiento con fármacos dopaminérgicos, que inhiban la secreción de prolactina como es la bromocriptina, aumenta el numero de muertes seguidas por infección, estando ello determinado por la disminución de los macrófagos y la producción de] interferón.
La prolactina es necesaria para la producción de IL-2 y células T. Los anticuerpos antiprolactina, inhiben la proliferación de linfocitos B y T. Los linfocitos son una fuente extrahipofisaria de prolactina conocida como «prolactina-like» (de iguales características a la hormona original) como de utilidad para que el SI aumente la reproducción de células inmunitarias.
La prolactina se contrapone a los efectos inmunosupresores de los corticoides, estando disminuida en el estrés.
La ciclosporina (utilizada en procesos infecciosos), podría producir una regulación descendente de los receptores de prolactina en los linfocitos. En tanto que los efectos de la inmunosupresión de la ciclosporina, son bloqueados por la acción de prolactina.
Los péptidos opioides están presentes en la hipófisis, cerebro y médula suprarrenal. El estrés aumenta las beta-endorfinas y el ACTH produciendo disminución de las células NK- En pacientes oncológicos el estrés es un factor que debiera evitarse, ya que puede aumentar el factor de crecimiento tumoral por falta del control inmunológico del mismo, por la disminución de las células NK. Esta disminución, que provoca un aumento de ACTH y péptidos opioides, puede ser bloqueada con el uso de naloxona.
La melatonina se relaciona con el SI a través de la regulación de los ritmos circadianos. La inhibición de la síntesis de melatonina, producida por el aumento de los ciclos de oscuridad o farmacológicamente por los (P-bloqueantes, dismninuye la respuesta inmunológica y la producción de anticuerpos. La melatonina durante la noche, aumenta la producción de anticuerpos, estimula la actividad de los linfocitos T-helpers y la síntesis y liberación de péptidos opioides específicos.
La melatonina desempeñaría un papel importante en la defensa contra los factores de estrés ambiental. El aumento de glucocorticoides exógenos o por la acción aguda del estrés, tiene efectos negativos sobre el SI. Estos efectos de los glucocorticoides pudieron ser bloqueados por la administración de melatonina,
De esta forma se comprueba que la glándula pineal, a través de la secreción de melatonina, antagoniza los efectos inmunosupresores del estrés agudo estimulando los péptidos opioideos, siendo la melatonina la que aumentaría la afinidad de los receptores opioides para sus ligandos. La activación de los receptores opioides podría aumentar la actividad linfocitaria.
Los bloqueantes opioideos, como por ejemplo la naltrexona, son antagonistas de la melatonina, por lo cual existiría un sistema de comunicación bidireccional entre el sistema opioide y la glándula pineal para mantener regulado el SI.
Son interesantes las investigaciones sobre la localización de un agente genético supresor asociado a la progresión del cáncer como son las terapias de contratranscripción genética sobre células tumorales, para aquellas células que son resistentes a la quimioterapia y a la terapia radiante. Esta terapia genética es una buena aproximación, para lograr el «suicidio» genético, de la células tumorales que han cambiado su transcripción. Ello es un intento de modificación de la fuente de expresión genética, a través de metabolitos proteicos o enzimas de conversión, que intentarían modificar la alteración y el atipismo de las células tumorales.
Existen un grupo de oncogenes implicados con la carcinogénesis (con el factor de crecimiento tumoral y la alteración en la expresión génica). Los oncogenes podrían haber sido activados por diferentes mecanismos y la persistencia del estímulo estresante o modificador de la expresión normal de los genes inmediatos (Inmediatly early gens), se los relaciona al cáncer de colon y al gástrico. (ver cap. 1, 1-13).
Relaciones entre el estrés y los procesos neoplásicos
Sólo el estrés crónico o con el de característica «inescapable» sería el único que estaría asociado a una modificación neurobiológica, que irrumpiría en la promoción inadecuada del aumento de estimulación aberrante del citosol hacia el núcleo, cambiando así la expresión génica con ulterior alteración SI.
Existen estímulos precisos y específicos para desencadenar estrés, según la especie y/o la tipología. El estrés es en general, pero no de manera uniforme, inmunosupresor. Sería el estrés inescapable el que puede provocar una supresión de la mitogénesis de la linfoproliferación.
Diferentes estudios pudieron comprobar que los sucesos cotidianos del ciclo vital (life events) pueden desencadenar respuestas sobre el SI. Así por ejemplo: la pérdida del cónyuge, la disrupción marital y la mala relación de los vínculos matrimoniales, decrecen la respuesta inmunológica antigénica, producen hipercortisolemia, disminuyen de manera significativa la proliferación de los NK (como respuesta a la prueba de estimulación por el mitógeno concanavalina-A) y se asocian a significativos decrementos de linfocitos T-helpers.
Algunos investigadores relacionan el aumento de incidencia del cáncer de mama en mujeres, con vida matrimonial conflictiva, si bien ello es controversial, ya que en los últimos diez años la progresión del mismo es muy alta y los motivos aún permanecen inciertos (una de cada ocho a nueve mujeres padecerá la enfermedad).
La aflicción permanente es reconocida como una causa significativa estresante y se la ha descrito como un factor de riesgo de inicio y de progresión del cáncer. Existe en estos pacientes una alteración de la inmunidad con reducción de la actividad de los NK, linfocitos T y T-helper. Asimismo, se relacionó el alto puntaje en la escala de depresión de Hamilton, con la disminución de los linfocitos T y de los T-helper en estos pacientes.
La aflicción permanente abarca diferentes poblaciones como la de las perturbaciones en los vínculos de pareja, el de los cuidadores de pacientes terminales con enfermedad de Alzheimer, la población de personas desocupadas, etc.
En lo que respecta al grupo de sujetos con parejas en crisis se desprendería que, los sujetos con buenos vínculos en su vida marital, tendrían menor riesgo de contraer cáncer que los de vínculos conflictivos. Este último grupo presenta un mayor riesgo en hombres y mujeres con edades superiores a los 75 años. En las investigaciones se efectuaron mediciones sobre las células NK el cortisol plasmático, el test de respuesta proliferativa al mitógeno concavalina-A o a la fitohemaglutinina. Sin embargo sólo se pudo comprobar las alteraciones del SI, en especial la disminución de las NK, en aquellos sujetos estresados, que presentaban importantes niveles de aflicción y abatimiento, demostrando así una vulnerabilidad recíproca psicoinmunológica. Aún con todo lo señalado, no se debería realizar tina lectura directa de inmunodeficiencia y comienzo de actividad neoplásica, ya que un sistema inmunológico disminuido por el estrés permanente o inescapable no implica el comienzo de una enfermedad proliferativa.
En relación a la depresión como factor de riesgo para contraer cáncer, ocurre algo similar ‘ que con el estrés. El tema es controversial, ya que hay estudios que afirman esta relación y otros que, en cambio, sostienen lo contrario.
Se conoce que los pacientes con diagnóstico de depresión mayor presentan:
1) Mayor sensibilidad de los receptores P-adrenérgicos en los linfocitos.
2) Un decremento del porcentaje de células T y Thelper.
3) Un decremento de la mitogénesis linfocitaria, comprobada por los tests de estimulación proliferativa.
Sin embargo, datos recientes tomados en una población de casi 10.000 mujeres, seguidas por un período de 14 años, no han podido encontrar ninguna asociación entre el MMPI, en la subescala de depresión, con el cáncer de mama. Asimismo, otro investigadores que evaluaron poblaciones con más de 500 sujetos durante 5 años, con escalas de autoadministración de síntomas depresivos, tampoco han podido de establecer coincidencias.
En cambio otros autores en poblaciones más pequeñas, que no llegan a los 50 individuos, encontraron correlaciones entre síntomas depresivos y cáncer pero en depresivos graves con decrementos de la respuesta inmunológica asociada a disregulaciones de la hormona de crecimiento, la hormona luteinizante y los cambios en el eje hipotálamo-hipofiso-tiroideo.
Sin embargo, se señala que los pacientes con más riesgo de decremento de linfocitos y aumento patológico del cortisol, serían los depresivos hospitalizados por largos períodos aunque estas alteraciones también podrían deberse a la hospitalización.
Por consiguiente, la población que presentaría deficiencia inmunológica y que habría que controlar con mayor cuidado serían los pacientes con:
a) depresión severa,
b) con depresión primaria de comienzo tardío, y
c) con períodos de largo tiempo de hospitalización.
Estos tres criterios son los únicos en los cuales puede documentarse fehacientemente una relación entre depresión y decremento de la respuesta inmunológica, ya que en sujetos sanos no se puede afirmar que la depresión aumente el riesgo de cáncer.
Otro problema es la depresión, en el paciente con enfermedad neoplásica, ya que en estos pacientes la depresión moderada o severa, a cualquier edad, puede afectar la respuesta al tratamiento quimioterápico, psicooncológico e inmunooncológico.
2-9. El paciente oncológico
El abordaje psicofarmacológico y psicoterapéutico en los pacientes oncológicos tiene efectos directos sobre la calidad de vida y efectos indirectos sobre el tiempo de sobrevida.
Se deben distinguir dos campos precisos y delimitados en los estudios de los pacientes con cáncer:
a) los que abarcan la génesis, y
b) los que se refieren al paciente oncológico.
En el primer grupo se estudia a los sujetos no enfermos, pero con riesgo de contraer la enfermedad. En el segundo el sujeto ya es paciente, dado que ha contraído la enfermedad.
Existen numerosos estudios que indican que el estrés y la depresión de estos pacientes están directamente asociados al pronóstico y evolución de la enfermedad y a la respuesta del tratamiento y cantidad de tiempo de sobrevida.
En forma similar a lo que sucede con los estudios, que investigan las relación es y la génesis del cáncer, existen aquí también pocos estudios con rigurosidad metodológica para tomar sus resultados en cuenta, ya que la bibliografía es superabundante, pero notablemente controversia].
Así por ejemplo pacientes con cáncer de mama que presentan un espíritu combativo de lucha, demuestran mayor sobrevida que aquellas pacientes desesperadas o con sensación de indefensión. Sin embargo otro estudio presenta resultados contrapuestos ya que se comprobó que pacientes depresivos y ansiosos, que recibieron terapia radiante, no mostraron mayor mortalidad que el grupo con menores síntomas de depresión y ansiedad, en un seguimiento realizado durante tres años.
Bajos niveles de adecuación, de continencia social y de fatiga, asociados a de depresión, fueron considerados por otro investigador, como predictores de mal pronóstico en pacientes con cáncer de mama. Se demostró que existiría una correlación entre los factores de estrés y depresión, con presencia de 3 de los ítems, ya que se encontró un 30 % de disminución de la activación de las células NK y linfocitos T. En este grupo aparecen con mayor frecuencia metástasis, que en otro grupo, con el mismo estado de enfermedad, pero sin los ítems descritos anteriormente.
Otros investigadores encontraron que altos niveles de estrés y baja continencia socio-familiar disminuyen la actividad de las células NK y el pronóstico empeoró en mujeres con cáncer de mama.
Los estudios practicados en animales de experimentación demuestran que el estrés aumenta la velocidad de mutación y el potencial carcinogénico.
Existen diferentes mecanismos inmuno-antitumorales relacionados con el factor de necrosis tumoral (TFN) y con el factor de crecimiento tumoral (TGF):
1) macrófagos, relacionados en el control del desarrollo tumoral;
2) citoquinas, interconectadas y relacionadas con la regulación celular, la inflamación, la reparación de tejidos, la inmunorrespuesta y que pueden producir anti-proliferación o pro-proliferación de diferentes células tumorales;
3) Interleuquinas: la activación de macrófagos y monocitos con la interacción de los linfocitos T producen la interleuquina 1, que al actuar sobre los Thelper induce la producción de la IL 1 y 4 e interferón (IFN). Los linfocitos helpers, pueden producir IL-2 e IFN (Th-l y 2), IL- 4 y 5. Las IL-1 y 2 están relacionadas con la proliferación antitumoral, la IL-4 con la activación de las células T y NK, la IL-6 con los factores de crecimiento de las células B y T, las IL-7, 10 y 12 con el factor de crecimiento de células T e inducción de las NK (Lymphokine activated killer, LAK). Por el momento sólo la IL-1, 2 y 4 están relacionadas con el tratamiento.
La IL-2 lleva la señal mitogénica para activar la proliferación de los linfocitos T. La LAK es activada por la proliferación celular después de un tratamiento con IL-2 y fue relacionada con remisiones en pacientes con melanoma y cáncer renal.
Existe un concepto fuertemente sostenido en ámbitos preferentemente de investigación psicológica, que la psicoterapia individual o grupal (en combinación o no con psicofármacos), estaría directamente asociada a la evolución del paciente oncológico y al tiempo de sobrevida.
Los estudios realizados en diferentes poblaciones con variedad de neoplasias (mama, colon, melanoma, próstata, anexiales, colo-rectales, pulmonar, estomacal, pancreático y metastásicas) con diferentes tipos de psicoterapias (dinámicas individuales o grupales, individual estructurada, comportamental especializada en oncología, entrenamiento en resolución de conflictos, estructurada educativa, no estructurada psicoanalítica, familiares, entrenamiento asertivo, anti-pensamientos invasivos, desensibilización, soporte expresivo, sofrología, psicoanalítica grupal) que utilizaron una muestra de 1.810 pacientes, no han podido documentar que la psicoterapia sola o en combinación con psicofármacos, haya tenido incidencia directa en la sobrevida del paciente.
Por el contrario, no hubo diferencias en términos generales en la cantidad de tiempo de sobrevida del grupo que recibió psicoterapia comparativamente con aquél que no la recibió (26b, 33a).
En cambio sí se demostró que el efecto de la psicoterapia mejoró notablemente la calidad de vida, ron respecto del grupo control que no recibía psicoterapia.
En el grupo que recibió psicoterapia se reportó:
– disminución de pensamientos intrusivos,
– disminución de la ansiedad,
– actividad sexual aun durante la enfermedad,
– menores problemas con la inducción de náuseas por la quimioterapia,
– decrecimiento del vómito anticipatorio a la quimioterapia,
– decrecimiento de la fatiga y de la fobia,
– mejor respuesta para enfrentar problemas.
Un solo estudio demostró un aumento del tiempo de sobrevida en mujeres con cáncer de mama. El grupo que recibió psicoterapia tuvo un promedio de sobrevida de 1.104 días (36,8 meses), mientras que el grupo que no recibió psicoterapia -que partió del mismo estado-, tuvo un promedio de sobrevida de 558 días (18,3 meses).
En la actualidad los nuevos psicofármacos que aparecen en el mercado son estudiados experimentalmente desde el punto de vista de la carcinogénesis, de la mutagénesis y sobre la fertilidad. Estas investigaciones, realizadas en diferentes especies constan en los prospectos e información al médico, realizados por las empresas farmaceúticas.
Se deberían tomar en cuenta criterios de selección muy especializados para el abordaje psicofarmacológico del paciente con cáncer, ya que se ha demostrado que el uso por tiempo prolongado de antidepresivos, benzodiacepinas y/o neurolépticos, puede alterar la función inmunológica y desarrollar tanto efectos antiproliferación de células tumorales, como efectos de pro-proliferación de éstas, al aumentar el factor TGE
Algunos autores sostienen que el uso de antidepresivos y tranquilizantes durante tiempo prolongado podría aumentar un tipo de cáncer epitelial de ovario y el decremento de la función inmune.
Si se toma en cuenta que en el tratamiento oncológico una de las vías de inactivación tumoral, puede ser la inmunodefensa o el desarrollo de factores inmuno-antitumorales, se comprenderá la contradicción de medicar durante largo tiempo a estos pacientes con psicofármacos, sin embargo el efecto antiemético de algunos neurolépticos así como también de la metoclopramida es bien conocido.
Sin embargo, esta forma de uso esta contraindicada para prevenir los vómitos inducidos por quimioterapia en pacientes pediátricos, por la posibilidad de la producción de reacciones extrapiramidales. Es por ello que se aconsejan inhibidores selectivos 5-HT3.
El uso de antidepresivos en pacientes con cáncer es frecuente. Sus indicaciones, no sólo están referidas al tratamiento de la depresión, sino también al tratamiento del dolor. Los tricíclicos son frecuentemente utilizados. El aumento de la noradrenalina modifica la transmisión de los ganglios espinales (vía de] dolor) y además el uso de tricíclicos, asociados a la morfina, aumenta la concentración plasmática de esta última.
También es común la asociación de anticonvulsivantes, antidepresivos tricíclicos y opiáceos. Esta combinación produce una disminución del dolor agudo. El tiempo de analgesia se logra recién a las 48 horas, aunque, sus mejores efectos aparecen al finalizar la primera semana.
De la revisión bibliográfica de los últimos años sobre la utilidad de los antidepresivos sobre la promoción o inhibición del cáncer, sólo aparece una correlación positiva de la amitriptilina con el aumento de la frecuencia del cáncer de mama y de hígado. Específicamente la amitriptilina, fue selectivamente asociada como promotora del factor de crecimiento tumoral (TGF).
La fluoxetina y la cloimipramina pueden actuar aumentando la proliferación tumoral de ciertas neoplasias, así como también como agentes antineoplásicos de otros tipos de cáncer.
Los antidepresivos más recomendados en el tratamiento del paciente oncológico son la imipramina y el citalopram, ya que ambos demuestran tener propiedades antineoplásicas.
Un abordaje especializado, realizado por un equipo con entrenamiento específico en psicobiooncología, podría mejorar el estado psicoinmunológico del paciente y producir a través de esta vía indirecta una mejor respuesta al tratamiento general, una mejor performance inmunoantitumoral y fundamentalmente una mayor adherencia al tratamiento oncológico específico, factores que de ninguna forma hay que desdeñar, pero que distan mucho del falso concepto de que la psicoterapia tiene efectos directos sobre la sobrevida del paciente oncológico.