Volver a ¨Psicofarmacología – Psicodinámica IV (Indice General)¨
3-7. 2) Neurolépticos atípicos
Se llaman así porque tienen efectos «atípicos» (comparados con los que tienen acciones «típicas o convencionales»):
a) poseen bloqueo dopaminérgico selectivo;
b) producen menos efectos neurológicos (extrapiramidalismos), y
c) actúan sobre síntomas negativos y resistentes.
Clasificados por su afinidad con los receptores
1) Antagonistas 5-HT, DA2, DA1, Alfa-1:
Clozapina, Melperone, Olanzapina, Quetiapina, Savoxepina, Zotepina, Zyprasidona
2) Antagonistas 5-HT2, DA2:
Risperidona, ICI 204636, RG 5222
3) Antagonistas DA2 selectivos:
Benzamidas sustituidas: Amilsuprida, Sulpirida, Sultoprida, Racloprida
4) Antagonista 5-HT2, DA2, Alfa-1
Amperozide, Sertindole
5) Otros
Setoperone, Pimpamperone, Fluperlapina
Se denomina así a un conjunto de fármacos antipsicóticos que tienen diferentes estructuras químicas, poseen efectos clínicos y mecanismos de acción similares, aunque se diferencian por presentar potencias distintas de sus acciones a nivel clínico y por sus afinidades por los receptores involucrados.
1) Poseen acción antipsicótica clínica, fundamentalmente, a nivel de los síntomas negativos.
2) Poseen muy pocos efectos extrapiramidales.
3) Desarrollan mínima o ninguna disquinesia tardía.
4) Causan mínimo o ningún aumento de los niveles de prolactina.
5) Experimentalmente, producen mínima o ninguna acción cataleptogénica.
6) Tienen acción antagónica sobre los receptores de serotonina 2 (5-HT2) y
de dopamina 1/2 (DA1/2), en particular en el sistema mesolímbico.
7) La relación de la constante de disociación (pk) para los ligandos de 5-HT y DA2 debe ser mayor que 1.
8) Pueden tener acción antagónica, preferentemente débil, sobre otros receptores (alfa-adrenérgicos, histamínicos y muscarínicos).
9) Son eficaces en un gran porcentaje de pacientes resistentes.
Es posible, que uno de los efectos terapéuticos de los neurolépticos atípicos se deba al bloqueo serotoninérgico, que modula la descarga de dopamina de la vía nigroestriadada. Además son menos disrruptivos de la descarga en la zona nigroestriada, que con respecto a las proyecciones dopaminérgicas mesolímbicas. Esta aparente especificidad, basada en la diferente distribución de subtipos de receptores permite reducir o abolir los síntomas esquizofrénicos, causando poco o nada de extrapiramidalismos. Sólo son capaces de producir efectos neurológicos cuando se han administrado en dosis muy superiores a las posologías terapéuticas.
Los síntomas negativos secundarios a neurolépticos, son habitualmente transitorios y variables. Por el contrario, los síntomas negativos primarios de la enfermedad son más persistentes.
Existen varios agentes en el mercado farmacéutico internacional, mientras otros aún se encuentran en la fase de investigación clínica.
Clozapina
La clozapina era, hasta la aparición de los nuevos antipsicóticos atípicos, el de primera elección para el tratamiento de pacientes con síntomas negativos, con esquizofrenia resistente o con intolerancia a la medicación neuroléptica clásica.
La clozapina es la N-Metil-Piperazinil-Dibenzodiacepina, desarrollada a partir de 1960, que luego de un gran entusiasmo inicial en 1970, se produjeron algunos casos de agranulocitosis en la población de origen nórdico
La clozapina tiene una afinidad relativamente baja por los receptores DA1 y DA2, a los que bloquea de forma pareja. Comparada con los neurolépticos típicos, muestra mayor bloqueo de los receptores DA1 Bloquea más específicamente los DA1, DA1A, DA1B, DA5, DA2 largo, DA2 corto, DA3 y DA4. Estas particularidades de bloqueo tienen que ver con su menor propensión a producir efectos extrapiramidales y disquinesias tardías. Tiene una acción con selectividad regional, preferentemente sobre regiones mesolímbicas.
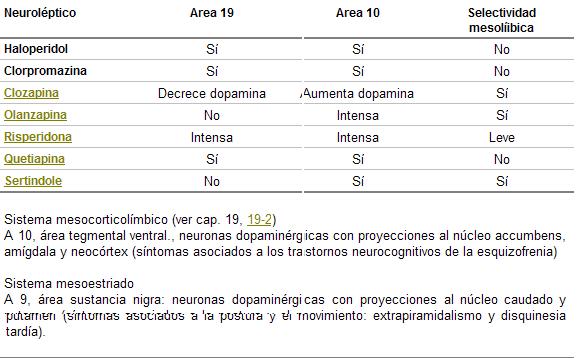
Cuadro 26. Efectos de los neurolépticos sobre las áreas mesolímbicas
Muestra una alta afinidad por receptores 5-HT2 (también 5-HT1), y aparentemente la combinatoria del antagonismo 5-HT2/D2, en 1.5 sería la clave de la acción atípica de la clozapina.
Actúa a nivel de otros neurotransmisores, bloqueando receptores muscarínicos, acetilcolínicos y alfa-adrenérgicos.
Aparentemente no interacciona con receptores sigmaopioides ni tiene una acción preponderante sobre el GABA.
La administración crónica de neurolépticos típicos reduce el turn-over del GABA en la región nigroestriada; por el contrario, la clozapina aumenta el turn-over del GABA. El deterioro a largo plazo del turn-over del GABA puede conducir a la degeneración de la vía nigroestriada y a la consiguiente inducción o exacerbación de la disquinesia tardía.
Dosis
En general, se comienza con 25 mg a la noche y se incrementa hasta 25-50 mg por día cada 2-3 días, según la tolerancia. Las dosis oscilan mayoritariamente entre 250-450 mg/d (rango extremo: 25-900 mg/d)
Usualmente, es preferible suspender la medicación anterior antes de incluir clozapina; en caso contrario, disminuir todo lo posible la medicación anterior e incluirla en forma gradual, respectivamente.
En cuanto al tiempo de utilizar la droga antes de considerarla ineficaz, algunos autores sugieren no persistir más allá de 6-8 meses si no se han obtenido resultados favorables. Otros sugieren que se debe esperar más tiempo, porque el efecto terapéutico puede aparecer después de varios meses. El tiempo de respuesta al fármaco diferencia fundamentalmente dos tipos de respondedores: los rápidos y los lentos (6 meses o más).
Farmacocinética
Posee una vida media promedia de alrededor de 11 horas.
Es posible que exista un efecto acumulativo, ya que se han reportado mejorías a partir de las 4-6 semanas en el 14 %; después de la octava semana, en el 32 % y después de la 12º-18º semanas, en el 41 %. De todas maneras, aun usada en dosis adecuadas (por encima de 900 mg) y por más de 6 meses, estadísticamente no es efectiva en el 40 % de los pacientes resistentes.
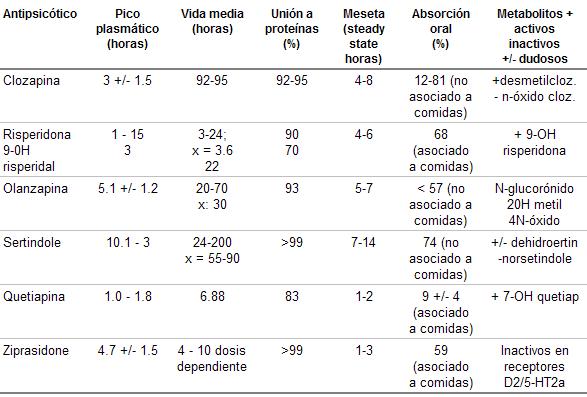
Cuadro 27.
Características farmacocinéticas de los antipsicóticos atípicos
Uso clínico
Su utilidad ha sido comprobada tanto para síntomas positivos (delirios, alucinaciones, etc.) como para síntomas negativos (embotamiento afectivo, apatía, abulia, etc.).
Estudios recientes, comparativos con risperidona, mostraron mejorías similares con ambas drogas en pacientes crónicos que presentaron exacerbaciones agudas, aunque permanece en discusión la eficacia de la risperidona en sintomatologías negativas, de manera exclusiva.
Es efectiva en la remisión de síntomas positivos y síntomas negativos. Raramente produce fenómenos extrapiramidales, puede elevar ligera y transitoriamente los niveles de prolactina. No produce disminución tan marcada de dopamina en el nivel hipotálamo-hipofisario.
Algunos clínicos recomiendan el uso de anticonvulsivantes cuando se la prescribe en dosis de más de 500 mg/d y en personas con antecedentes epilépticos.
El valproato sódico es una elección apropiada en estos casos, porque no parece alterar el metabolismo de la clozapina. Se ha comprobado su efectividad también en cuadros maníacos.
La clozapina ha sido combinada de forma segura con litio y antidepresivos; puede haber riesgo de excesiva depresión del SNC combinada con benzodiazepinas.
También se la ha empleado con efectividad en trastornos esquizoafectivos, maníaco-depresivos, y como coadyuvante en el tratamiento con litio u otros antirrecurrenciales, en aquellos pacientes que no responden solamente a estos últimos. También se la usa en el tratamiento de otras psicosis severas (agitación o cuando aparecen síntomas extrapiramidales importantes en pacientes con enfermedad de Parkinson). Por sus efectos antipsicóticos y antidiscinéticos también se la aconseja para pacientes con discinesia tardía inducida por otros agentes.
Ha sido demostrada su eficacia en pacientes esquizofrénicos resistentes por lo menos a tres neurolépticos: luego de probar la falta de efectividad del haloperidol en 318 pacientes durante 6 semanas en dosis altas se asignaron en forma doble ciega, a un grupo clorpomazina (hasta 1.800 mg/día) y al otro clozapina (hasta 900 mg/día). El 30 % de los tratados con clozapina respondieron favorablemente Vs. el 4 % de los tratados con clorpromazina, y en otro estudio de 29 semanas fue superior en un 60 % frente al haloperidol (12 %)..
En los pacientes esquizofrénicos tratados con clozapina el índice de suicidios disminuyó marcadamente: del 0,4-0,8 % (neurolépticos estándares) al 0,09-0, 18 %. También se ha disminuido el número de hospitalizaciones y paralelamente ha mejorado la calidad de vida de dichos pacientes.
Efectos adversos
Está contraindicada en trastornos mieloproliferativos, discrasias sanguíneas y leucopenias, como también su uso simultáneo con otros agentes (como la carbamazepina) con potencia] agresivo a nivel de la médula ósea.
Excepto las convulsiones (3 %), la temprana sedación (39 %) y la hipotensión (9 %), los demás efectos no parecen aumentar en severidad con el aumento de la dosis.
La hipersalivación (presente en el tercio de los pacientes), especialmente durante el sueño, es un efecto poco explicable dada su alta acción anticolinérgica. Otro efecto antiparasimpático es una moderada taquicardia sinusal (25 %). Por este mismo motivo debe ser usada cuidadosamente en pacientes con íleo, glaucoma o retención urinaria.
La toxicidad central anticolinérgica contribuye al riesgo de confusión y delirio. Pueden observarse pequeñas elevaciones de la temperatura corporal (5 %) que deben diferenciarse de la febrícula de la infección asociada a agranulocitosis y al síndrome neuroléptico maligno. Este último ha sido reportado en pacientes que recibían clozapina con litio y/o carbamazepina.
Al menos un tercio de los pacientes que son tratados con clozapina aumentan de peso por razones desconocidas (4 %).
Otros efectos secundarios observados son: hipertensión (4 %), síntomas gastrointestinales (14 %), y cambios electrocardiográficas (1 %). Se ha descrito aparición de arritmias, anomalías plaquetarias, púrpura trombocitopénica y aumento de la agregación plaquetaria; todas ellas son raras. Más frecuentes son la leucocitosis y la cosinofilia que no tienen significación clínica.
La agranulocitosis se detectó por primera vez en Finlandia en 1975: 16 pacientes tratados con clozapina desarrollaron granulocitopenia, y trece, agranulocitosis. De estos últimos, ocho fallecieron por infección sobrecargada.
Estadísticas posteriores con riguroso monitoreo sanguíneo bajaron la incidencia de esta complicación al 1-2 % (10-20 veces más que con otros neurolépticos). Algunas estadísticas norteamericanas mencionan un 0,6 % de agranulocitosis (47 de 7500 pacientes) detectada por monitoreo semanal con un solo caso fatal (2).
Una severa granulocitopenia puede comenzar transcurrido el primer año de tratamiento; sin embargo, en el 50 % de los casos aparece en los primeros doce meses, y cerca del 75 %, en los primeros 6 meses (en general, entre 6-18 semanas). Se sospechan mecanismos inmunológicos y/o tóxicos similares a los de otras drogas.
Las características de la agranulocitosis inducida por la clozapina:
Incidencia: 1 % – 2 %.
Aparentemente no relacionada con dosis total ni con duración de la terapia, pero el período de riesgo sería entre la 6°a y la 18° semana.
Tipo de paciente más susceptible:
mediana edad, posiblemente determinados grupos étnicos (finlandeses y, judíos).
Mecanismo poco claro, existen evidencias de mecanismos, de tipo tóxico y de tipo inmune.
Habitualmente, de instalación gradual, pero puede hacerlo rápidamente.
La disminución de los glóbulos blancos puede ser abrupta o gradual. Una caída abrupta de alrededor de 3.000 glóbulos blancos, en una semana puede preanunciar el riesgo de una agranulocitosis.
El recuento leucocitario debe realizarse una vez por semana durante los primeros cuatro meses; una vez por mes hasta el segundo año y a partir del tercer año, trimestralmente. Se debe vigilar o suspender la medicación cuando la leucopenia esté por debajo de 3500/ mm², o la granulocitopenia por debajo de 1500/mm’. Es conveniente la vigilancia semanal de los glóbulos blancos, ya que pueden aparecer oscilaciones que se recuperan espontáneamente.
En pacientes con recuentos leucocitarios de 3.000/mm’ o en aquellos con neutropenias de alrededor de 1.000/mm’ el recuento debe ser bisemanal.
Incluso, en algunos casos se aconseja realizar el conteo luego de una ingesta alimenticia abundante, dado que muchos de los pacientes presentan cuadros de alimentación deficiente o síntomas anoréxicos, que disminuyen el recuento (73).
Hay poco más de 100 casos registrados en el mundo de agranulocitosis y hasta el momento algo más de 10 pacientes en los EEUU. De hecho no se repitió ninguna casuística similar a la finlandesa en el resto del mundo.
El riesgo mayor de agranulocitosis es entre la 6° y 18° semana de tratamiento. Es conveniente en caso de una agranulocitosis no complicada (fiebre, dolor de garganta, letargo, sensación de debilidad, presentes o ausentes):
1. hospitalizar al paciente;
2. suspender el tratamiento con clozapina;
3. derivar al hematólogo;
4. aislamiento máximo para reducir el riesgo de infección;
5. controlar frecuentemente la temperatura corporal;
6. hacer chequeo clínico frecuente para detectar signos o síntomas de infección local, y
7. monitoreo hematológico regular hasta que aparezcan valores normales;
8. administrar estimulantes leucocitarios;
9. no medicar nunca más al paciente con clozapina (idiosincrasia).
Combinaciones e interacciones
En combinación con las BZD puede producir dificultad respiratoria, habitualmente poco importante.
Combinada con litio ha sido implicada en algunos casos de síndrome neuroléptico maligno. Sin embargo esta asociación sólo debe ser considerada cuando los síntomas maníacos o hipomaníacos no son adecuadamente controlados solamente con clozapina.
Las drogas que inducen el metabolismo hepático pueden disminuir los niveles plasmáticos de clozapina. Esto ocurre, por ejemplo, con drogas anticonvulsivantes como la fenitoína, barbitúricos o antidepresivos. En estos casos, puede ser de utilidad dosificar los niveles plasmáticos o aumentar la dosis de clozapina.
Finalmente, asociada a otros neurolépticos, aun en pequeñas dosis, puede incrementar el riesgo de síndromes extrapiramidales y/o producir disminución de la eficacia en el tratamiento de los pacientes resistentes.
Risperidona
La risperidona es un potente antagonista 5-HT2 (25 mayor que el haloperidol) in vivo.
La afinidad por el receptor DA2 es 2,94,5 veces mayor en el tubérculo olfatorio y núcleo accumbens (sistema mesolímbico), que para el haloperidol y 5,144,3 veces menor para los del cuerpo estriado o sustancia nigra (sistema nigroestriado) (cuadro 26).
Es posible que el antagonismo 5-HT reduzca el antagonismo sobre el DA2 en la vía nigroestriada, posiblemente por un aumento de la liberación de la dopamina.
Antagoniza de manera potente los receptores alfa 1 y alfa 2 adrenérgicos y el HI. A diferencia de la clozapina, no se une a receptores colinérgicos muscarínicos.
Estudios realizados con tomografía por emisión de positrones (PET), han revelado que la risperidona ocupa los receptores serotoninérgicos en un 8090 %. Posee antagonismo D2, relativamente potente (haloperidol > risperidona > perfenazina > clorpromazina > clozapina).
Tiene una alta afinidad por el receptor alfa-1adrenérgico y por el histamínico-1, cuyo bloqueo (en dosis altas), explicaría la hipotensión ortostática, por la falta de taquicardia compensadora.
El bloqueo serotoninérgico (5-HT2) aumentaría los niveles de dopamina y serotonina en la corteza prefrontal específicamente provocando la mejoría de los síntomas negativos
Es posible que el antagonismo 5-HT, produzca un menor bloqueo del DA2 en la vía nigroestriado, por un aumento de la liberación de la dopamina, con reducción de su efectos extrapiramidales.
Farmacocinética
Se absorbe rápidamente en menos de 15 minutos, alcanza su pico plasmático a las 2 horas. La vida media es de 3 a 24 horas, tiempo que incluye al de su metabolito activo la 9-OH risperidona. El tiempo en que logra la meseta plasmática (steady state), es de 1 a 7 días para risperidona y de 5 días para la 9-OH risperidona (12).
La eliminación, que incluye a su metabolito activo (9-hidroxi-risperidona), es de alrededor de 24 horas (cuadro 27).
Dosis
La dosis terapéutica oscila entre 4-8 mg/día. Se recomienda comenzar con 1-2 mg 2 veces/día durante 3 días; según la respuesta clínica el incremento debe ser gradual hasta llegar a 3 mg 2 veces/día. De esta forma es posible evitar la aparición de la hipotensión ortostática, que puede producirse al inicio.
Se absorbe rápidamente en menos de 15 minutos, alcanzando su pico plasmático a las 2 horas. La vida media es de alrededor de 3 horas y la eliminación, que incluye a su metabolito activo (9-hidroxi-risperidona), es de alrededor de 24 horas.
Se recomienda comenzar con 0,5 mg/día e incrementar diariamente la dosificación hasta a 2-4 mg/día, a fin de reducir al mínimo el bloqueo alfa-1 adrenérgico, que puede ocasionar una hipotensión ortostática por falta de taquicardia compensadora.
Uso clínico
Su eficacia fue demostrado en pacientes crónicos y agudos. Comparada con el haloperidol con las escalas PANSS mostró mejoría de síntomas positivos y en especial de los negativos en dosis de 6 mg/día vs. haloperidol 10 y 20 mg/ día.
Comparando la risperidona (4-8 mg/día), con clozapina (400 mg/día) en pacientes agudos y con esquizofrenia resistente no hubo diferencias significativas en la reducción de los valores de la BPRS, PANSS y CGI, pero sí en la menor sialorrea del grupo tratado con risperidona (ver escalas, cap. 1-27).
Se trataron también con risperidona un grupo de pacientes esquizoafectivos, subtipo bipolar y apareció un incremento de los síntomas maníacos. Cuando se agregó un agente estabilizador o se disminuyó la dosis de risperidona, los individuos con síntomas depresivos mejoraron.
También se obtuvieron mejorías en casos de depresiones psicóticas, con disminución de la ideación paranoide.
Existen estudios que demuestran su utilidad en el síndrome de Tourette.
En estudios a largo plazo (un año), en pacientes resistentes se obtuvo un descenso de los días de internación como marcador de mejoría (Addington)
Efectos adversos
Los más comunes son: prurito, taquicardia, trastornos de la acomodación ocular, salivación, trastornos de la micción, diarrea, aumento de peso y alteraciones de la función sexual. El aumento de la prolactina es dosis dependiente.
Hubo casos de priapismo (1 caso), convulsiones por hiponatremia (3 casos) y síndrome neuroléptico maligno (3 casos).
En dosis superiores a los 10 mg/día aparece insomnio y efectos extrapiramidales. No hay evidencia de que pueda causar disquinesia tardía (en algunos casos la risperidona disminuyó o logró su remisión) (Chouinard 1995).
Cuando se la comparó con el haloperidol, los efectos extrapiramidales fueron menores, pero la taquicardia, el aumento de peso y la amenorrea fueron más notorios en el grupo con risperidona.
Los extrapiramidalismos y el síndrome amenorrea-galactorrea son de baja incidencia. Aún no existe tina experiencia clínica importante en pacientes resistentes (53).
Cambio de otro neuroléptico a risperidona
Es conveniente el mantenimiento del neuroléptico convencional de alta potencia y realizar disminuciones graduales de la dosis durante un tiempo prudencial, que oscila entre una semana y uno o dos meses, según el tiempo de exposición al neuroléptico. Ello se debe a la posibilidad de que pueden empeorar los síntomas extrapiramidales, lo cual no debe atribuirse necesariamente a la nueva droga, sino que puede ocurrir por la suspensión simultánea del neuroléptico y/o los antiparkinsonianos.
Algunos autores han reportado casos de empeoramiento de los síntomas psicóticos luego de comenzar el cambio de clozapina a risperidona y otros pacientes evidenciaron un empeoramiento de efectos adversos. La supersensibilidad de los receptores o un rebote colinérgico luego de la suspensión abrupta ha sido propuesta especialmente si a síntomas de agravamiento de la psicosis se agregan: diaforesis, náuseas, vómitos, agitación, confusión y síntomas extrapiramidales. La recomendación es de disminuir gradualmente la clozapina, durante 2 a 4 semanas, mientras se instituye lentamente le tratamiento con risperidona.
Olanzapina
La olanzapina es químicamente similar a la clozapina.
Se caracteriza por:
1 ) La afinidad por receptores dopaminérgicos DI a D5, es relativamente no selectiva y menor que la del haloperidol, aunque ligeramente superior a la de clozapina.
2) Tiene gran afinidad por receptores 5-HT (más que el haloperidol), en particular una gran afinidad por los 5-HT2 y moderada afinidad por los 5-HT3 y 5-HT6. Se diferencia de la clozapina porque carece de afinidad por receptores 5-HT7 (cuadro 13, 14, 15, 16, y 17).
3) Tiene gran afinidad por receptores muscarínicos, MI a M5, sitios en los que el haloperidol casi no actúa. In vitro no es agonista de receptores muscarínicos y los bloquea con moderada potencia. No se ha observado compromiso de la memoria por efectos anticolinérgicos.
4) Tiene gran afinidad por receptores alfa-1 adrenérgicos e histaminérgicos HI. Es menos potente, in vivo, para bloquear receptores alfa-1 adrenérgicos. Tiene poca afinidad por receptores beta-adrenérgicos. Al igual que el haloperidol (pero no la clozapina), tiene baja afinidad por receptores alfa-2 adrenérgicos.
5) Tiene poca afinidad por receptores opiáceos y glutamatérgicos.
6) Es un antagonista D2 en el área mesolímbica (estriado y núcleo accumbens) (cuadro 27).
7) Bloquea receptores serotoninérgicos (in vitro, in vivo), especialmente 5-HT 2a, en relación con receptores D2, la relación sería de 1.4 en dosis de 5-10 mg/día (similar al clozapina), y en dosis altas actuaría como la risperidona
8) Muestra selectiva actividad a nivel de receptores del área mesolímbica (A 10).
9) No produce agranulocitosis.
10) El rango de dosis terapéutica es de 10-20 mg/día.
11) Tiene bajo potencia] para producir extrapiramidalismos.
Farmacocinética
Se absorbe bien ya sea en presencia o en ausencia de alimentos. Muestra una farmacocinética lineal y proporcional a la dosis (cuadro 27).
La concentración plasmática máxima aparece a las 5-8 hs. después de su administración y tiene una vida media de 30 hs. Aproximadamente, el 93 % se une a proteínas plasmáticas. La variabilidad entre la concentración plasmática más alta y la más baja, a la misma dosis, es de 4 veces.
Se metaboliza en hígado por las vías de conjugación y oxidación. Los estudios in vitro, con microsomas hepáticos humanos, han demostrado que la olanzapina tiene poca capacidad para inhibir el metabolismo, por vía de los citocromos P 450, lo que sugiere un bajo potencial para interaccionar in vivo con otros fármacos, que actúen como sustratos para esos citocromos.
No ha demostrado interacción con litio o biperideno, sí en cambio con la carbamazepina. Las dosis múltiples de carbamazepina, indujeron el metabolismo de la olanzapina, lo que produjo a un aumento del 44 % en la depuración y a una reducción del 20 % en la semivida de eliminación terminal de la olanzapina. Sin embargo estos efectos no fueron considerados lo suficientemente significativos, como para exigir ajustes de las dosis de ninguno de los fármacos.
Con la combinación con diazepam se observó un efecto farmacodinámica, con ligero aumento de la frecuencia cardíaca, sedación y sequedad de boca.
La administración de una sola dosis de alcohol etílico, a pacientes tratados con olanzapina, ocasionó un aumento de la frecuencia cardíaca y una acentuación de la hipotensión postural. Es conveniente advertir a los pacientes tratados, sobre el consumo concomitante de alcohol.
El 57 % se excreta por vía renal y el 30 % por heces. Se observó una vida media más prolongada en ancianos (más de 65), en mujeres y en no fumadores.
Dosis
La dosis inicial recomendada es de 10 mg/día, en una sola toma y en cualquier momento del día.
Se puede ajustar la dosis, de acuerdo a la respuesta dentro del rango de 520 mg/día. Una dosis menor a los 5 mg/día sólo es aconsejable en pacientes mayores de 65 años, con disfunción hepática o renal o cuando existan factores que pudieran conducir a una metabolización más lenta del fármaco (sexo femenino, edad avanzada, no fumadores).
Uso clínico
En un estudio multicéntrico, que abarcó a 1996 pacientes, comparativo con haloperidol durante 6 semanas, la olanzapina obtuvo mejorías, comprobado por la escala BPRS, con tina menor cuota de abandonos (ya sea por mejor eficacia o menores efectos adversos), comparado con el grupo que recibió haloperidol. Mejoraron los síntomas depresivos en la subescala de depresión y los efectos extrapiramidales fueron escasos.
En dosis de 16.4 + 4 mg/día demostró superioridad en la sintomatología negativa, frente al placebo y el haloperidol, sobre todo en la escala SANS (ver cap. 1, 1), en especial en el «aplanamiento afectivo» y en los de «volición y apatía».
Efectos adversos
Los efectos adversos más comunes, en un relevamiento de 3100 pacientes (800 tratados por seis meses y 300 por un año) fueron: somnolencia, sensación de dificultad respiratoria, constipación, faringitis (por sequedad de mucosas), incremento del apetito y ganancia de peso (entre la 61 y 81 semana de tratamiento).
Hubo elevación de las transaminasas hepáticas (2-9,4 %, en la 111 – 211 semana de tratamiento, sin síntomas clínicos de disfunción hepática). No hubo evidencias de agranulocitosis y de efectos anticoinérgicos severos.
Hubo moderados y transitorios aumentos de prolactina y la incidencia de efectos extrapiramidales fue baja, aunque se señala, que en dosis superiores a los 10-15 mg/día, aparece un aumento de los porcentajes de acatisia y síntomas disquinéticos comparados con los controles.
Sólo el 20 % de pacientes, del grupo de olanzapina (10-15 mg/día), necesitó de la administración de antiparkinsonianos vs. el grupo de haloperidol (15 mg/día), que lo requirió en un 70 %, y del placebo que los necesitó en el 12 %.
Sobredosificación
La mayor sobredosis registrada fue de 300 mg/ día (15 veces la dosis máxima recomendada), que provocó somnolencia y lenguaje titubeante, sin otros efectos clínicos ni evidencias de síntomas adversos cardíacos, anomalías hematológicas o disfunciones hepáticas o renales. En caso de sobredosificación el carbón reduce, en forma significativa, la biodisponibilidad de la dosis oral.
No se debe usar en estos casos, fármacos simpáticomiméticos con actividad agonista beta, como los derivados adrenérgicos, porque puede empeorar la hipotensión.
Melperone
Tiene una propiedad bloqueante característica hit and run, es decir bloqueo no sostenido y de menor potencia. Su acción a nivel de los receptores D2 es mayor en el sistema límbico que en el estriado.
Posee alta afinidad por receptores serotoninérgicos y baja afinidad por receptores alfa-adrenérgicos y muscarínicos. Produce pocos efectos extrapiramidales, anticolinérgicos y cardiovasculares.
Luego del tratamiento con melperone se ha comprobado descenso del MOPEG y del turn-over de NA, por lo que se postula que su efecto antipsicótico podría originar un fuerte bloqueo del NA combinado con disminución de la actividad dopaminérgica. Puede disminuir el umbral convulsivo.
Presenta un buen efecto terapéutico en estados confusionales, agitación y ansiedad, sin disminución del estado de vigilancia. Es menos efectivo en las alucinaciones y los delirios, pero de muy buena tolerancia en pacientes geriátricos, por su baja incidencia de efectos adversos neurológicos e hipotensivos. Puede producir distonías y parkinsonismo en dosis mayores de 200 mg/d. La incidencia de leucopenia, trombocitopenia e ictericia es baja. Dosis: 300 mg/d (rango: 25-450 mg/d).
Amperozide
Es un derivado de la difenilbutilpiperidina y, a semejanza de la pimozida, presenta una alta afinidad por el DA2 en los sistemas mesolímbico y mesocortical.
Posee un potente efecto sobre los movimientos inducidos por anfetaminas, sobre la ansiedad y sobre la agresión, como así también propiedades antidepresivas.
A diferencia de la clozapina, carece de afinidad por el receptor DA1, es un bloqueante del receptor 5-HT2 e inhibe la recaptación de noradrenalina.
Tendría influencia en la transmisión glutaminérgica, ya que contrarresta la hipermotilidad producida por la ketamina, que es un antagonista del receptor N-Metil-D-Aspartato (NMDA).
Su acción sobre el sistema límbico podría deberse, en parte, a esta acción que explicaría el turn-over de la noradrenalina en la corteza cerebral, cambiando el balance entre DA y glutamato en favor de este último.
Mejora los síntomas negativos, no es de gran utilidad para los positivos y carece de efectos extrapiramidales.
Los efectos colaterales son náuseas, vómitos, somnolencia, alteración del sueño, incremento de la salivación y sudoración.
La dosis es de 5-20 mg/d.
Sertindole
Tiene una alta afinidad por los receptores DA2 del sistema límbico, 5-HT2 y alfa-1 adrenérgico (cuadro 26)
Es menos potente sobre el DI, alfa-2 adrenérgico, H1, sigma y muscarínico.
En un estudio doble ciego en 497 pacientes comparativo con placebo y haloperidol, durante 8 semanas en dosis de 12, 20 y 24 mg/día todos los pacientes mejoraron respecto del placebo. La dosis más eficaz fue la de 20 mg/ día. No se registraron efectos extrapiramidales con sertindole.
Tiene una vida media de 55-90 horas (cuadro 27).Se debe vigilar a los metabolizadores lentos ya que actúa sobre el citocromo P450 2D6, lo cual puede provocar el aumento de su concentración plasmática.
Por sus aciones bloqueantes alfa-1 participa de los efectos adversos de cefalea, insomnio, hipotensión ortostática y disminución del volumen eyaculatorio
Quetiapina (Seroquel, EE. UU.)
Tiene afinidad por los receptores DI, D2, 5-HT 2a, 5-HT la, alfa-1 y alfa-2. Mayor afinidad por el 5-HT que por el D2 y poca por los receptores muscarínicos.
Actúa preferentemente a nivel del área A10 mesolímbica (por esta selectividad tiene baja incidencia de extrapiramidalismos). En animales de experimentación produce disminución del número de receptores 5-HT2, en la corteza frontal y en perros se desarrollaron cataratas (cuadro 26).
La utilidad de la dosis alta (750 mg/día) frente a las dosis bajas (250 mg/ día), fue realizada en 280 pacientes internados, con mayor efectividad en los síntomas positivos que en los negativos. La dosis más útil rondaría los 300 mg/ día(cuadro 27).
Los efectos adversos más comunes fueron: somnolencia (bloqueo HI), mareos, constipación, hipotensión postural (bloqueo alfa-1), sequedad de boca, aumento de peso, escasos extrapiramidalismos e hiperprolactinemias, aumento de la aminotransferasa hepática y de la tiroxina.
Dado su metabolización por el citocromo P450 3A4, se recomienda vigilar las interacciones con nefazadone, fluvoxamina, antifúngicos, eritromicina, por la posibilidad de incrementar las concentraciones plasmáticas de quetiapina.
Se recomienda iniciar el tratamiento con 25 mg/día y titularla lentamente afín de disminuir los riesgos de hipotensión postural (tabletas de 25, 100 y 200 mg) y el control oftalmológico del cristalino para detectar cataratas por medio de lámpara de hendidura antes y durante el tratamiento (1 a, 13 a, 30 a, 61 a, 75b).
Zotepina
La zotepina es un antipsicótico derivado de la dibenzodiazepina, útil en el tratamiento de la esquizofrenia aguda y crónica desarrollado en Alemania por los laboratorios de Knoll-BASF Ha sido usado en Japón desde 1983 y desde entonces mas de 50.000 pacientes han sido tratados con este fármaco en Europa.
Presenta semejanzas químicas con las fenotiazinas, tioxantenos y las dibenzodiazepinas.
Tanto la zotepina como su metabolito, la norzotepina muestran una equilibrada afinidad por receptores D1 (D1, D5) y D2 (D2, D3, D4). Esta inhibición balanceada de los dos subtipos de receptores dopaminérgicos a nivel de la corteza límbica, explicaría la baja incidencia en la producción de síntomas extrapiramidales.
Muestra afinidad por los receptores 5-HT 1A, 1D, 2A, 2C, 3, 4, 6 y 7, a diferencia de la afinidad del haloperidol demostrada sólo para el 5-HT2C.
En animales de experimentación también ha mostrado afinidad por receptores 5-HT. Por otra parte inhibe la recaptación de noradrenalina y tiene baja propensión para inducir catalepsia. Ha sido más potente que la clozapina y la tioridazina, pero menos que el haloperidol.
En estudios comparativos con haloperidol la zotepina resulta más eficaz, en la remisión de síntomas negativos.
También ha sido efectiva en el tratamiento de la depresión y la ansiedad de pacientes esquizofrénicos (probablemente por inhibición de receptores NA).
Ha demostrado efectividad en la remisión de síntomas positivos y negativos. Por su neto perfil atípico presenta baja incidencia en la inducción de síndromes extrapiramidales. Tampoco se han reportado casos de disquinesia tardía y/o acatisia.
Algunos estudios muestran un buen efecto sobre las funciones cognitivas, incluso superior a las observaciones realizadas con clozapina y con los neurolépticos convencionales.
No se han descrito anormalidades en el ECG y los efectos anticolinérgicos en general han sido escasos. Dentro de los efectos secundarios más comunes se describe la propiedad uricosúrica y el insomnio.
Se absorbe rápidamente después de la administración oral. Su biodisponibilidad sistémica es del 7-13 %, luego del primer paso hepático. El pico plasmático se alcanza dentro de las 3-5 hs.
Las dosis oscilan de 75-100 mg/d en pacientes ambulatorios, llegando hasta 450mg/d durante la internación. Se presenta en tabletas de 25, 50 y 100 mg.
Zyprasidona
Es un derivado benzothiazol piperazínico desarrollado por el laboratorio Pfizer, aún no comercializado.
Es un potente antagonista 5-HT2A y D2 con un elevado cociente de bloqueo de la relación serotonina/dopamina.
Es un agonista 5-HT1A y antagonista 5-HT 1D y 5-HT2. Inhibe de forma moderada la recaptación de serotonina y noradrenalina in vitro.
Además de su acción antipsicótica, la predicción es de menores efectos extrapiramidales, cardiovasculares y sobre la sedación y cognición en comparación con otros antipsicóticos atípicos (cuadro 27).
Efectos adversos de los neurolépticos atípicos
Extrapiramidalismos
Estos efectos son observables en pacientes tratados con fármacos que bloquean más del 80 % de receptores D2 en el estriado y en los ganglios de la base (neurolépticos típicos). En contraste, los neurolépticos atípicos, bloquean un porcentaje menor al 80 % y actúan como antagonistas de receptores muscarínicos, colinérgicos y serotoninérgicos (5-HT2A), por lo cual la probabilidad de desarrollar estos efectos es mucho menor.
Tanto con clozapina, olanzapina y sertindole, no se han encontrado diferencias significativas con placebo, lo mismo ha ocurrido con dosis bajas de risperidona (en dosis superiores a los 10 mg/día el consumo de antiparkinsonianos aumenta de manera significativa.
La olanzapina y la clozapina, tiene bajo potencial para producir disquinesias tardías, no así la risperidona que presenta un riesgo mayor.
Convulsiones
Muy raras de observar en pacientes tratados con neurolépticos atípicos, excepto con clozapina (dosis dependiente).
Sedación
Usualmente está asociada al antagonismo de los receptores muscarínicos, histamínicos y colinérgicos. Generalmente este efecto es buscado para tratar ciertos pacientes. La clozapina es el de mayor efecto, seguido por la olanzapina La risperidona y el sertindole no son sedativos.
Síndrome Neuroléptico Maligno
El mayor riesgo es con neurolépticos típicos aunque también se ha observado con clozapina y risperidona. No se han reportado casos con olanzapina o sertindole.
Hematotoxicidad
Solamente observada en pacientes tratados con clozapina.
Efectos: cardiovasculares
Se ha observado hipotensión ortostática, por antagonismo con receptores alfa-adrenérgicos, con clozapina y con olanzapina.
El alargamiento del intervalo Q-T ha sido observado con neurolépticos de alta y baja potencia. Con sertindole el efecto es dosis dependiente, pero dicha alteración no se correlaciona en general con ningún efecto clínico adverso.
Función hepática
Pueden elevarse y volver a valores normales en 2-6 semanas (olanzapina, quetiapina).
Prolactina
Frecuentemente aumenta en tratamientos con neurolépticos típicos. También aumenta cuando se administran altas dosis de risperidona. El aumento es mucho más moderado con clozapina, olanzapina y sertindole.
Efectos anticolinérgicos
Frecuentes de observar con clozapina, moderados con olanzapina (sobre todo sedación y constipación).
Disfunción sexual
En el 20 % de los hombres tratados con sertindole se ha observado disminución del volumen eyaculatorio (mecanismo desconocido).
Peso
Se ha constatado aumento de peso con todos ellos. El mecanismo no ha sido aún del todo aclarado. Se ha especulado que el antagonismo serotoninérgico desempeñaría un papel muy importante.
3) Fármacos en desarrollo clínico
Los fármacos antagonistas 5-HT3, antagonistas DA1 agonistas parciales DA1 no están aún en desarrollos clínicos comprobados.
Neuropéptidos opioides
Los neuropéptidos opioides son sustancias endógenas con actividad similar a la de la morfina, con características fundamentalmente analgésicas, que pueden ser liberados a la corriente sanguínea principalmente desde la hipófisis, el hipotálamo, el sistema activador ascendente, ante estímulos estresantes ligados a la ACTH y corticoides.
Se han caracterizado tres tipos de receptores (mu, kappa y sigma): la morfina es agonista del receptor mu, el haloperidol antagonista del sigma y la naloxona antagonista de todos.
La gran molécula de ACTH puede originar por proteólisis endorfinas o encefalinas de menor cantidad de aminoácidos (derivados de la pro-opio-melano-cortina, de la proencefalina y de la pro-dinorfina).
Aún es prematuro afirmar la utilidad clínica de las beta-endorfinas o sus análogos sintéticos.
La catalepsia provocada en ratas (rigidez muscular e inmovilidad en posturas anormales que se hace adoptar a estos animales) con la administración de beta-endorfinas indicaría una alteración del balance endorfínico más que una alteración de los valores absolutos de estos neuropéptidos. Esta acción puede ser antagonizada por la naloxona (antagonista de receptores opiáceos).
Si bien se han encontrado valores elevados de beta-endorfinas en el líquido cefalorraquídeo de enfermos esquizofrénicos, estas determinaciones no pueden correlacionarse con los síntomas de sedación, catatonía y abulia que estos péptidos producen en forma experimental.
La administración intravenosa de 10 mg de beta-endorfina sintética humana o de 1 mg intramuscular del análogo des-tir-gamma-endorfina en su forma retardada con fosfato de zinc mostró resultados de difícil evaluación, dados los pocos enfermos tratados (en algunos casos euforia y en otros atenuación de la agresividad) (6, 23). La forma de actuar de este neuropéptido sería a través de la neuromodulación de otros neurotransmisores, en especial de la dopamina.
Antagonistas de receptores opiáceos
La inhibición del fenómeno de catalepsia endorfínica en ratas mediante la administración de naloxona (antagonista del receptor opiáceo) sugirió su probable utilidad clínica en enfermos esquizofrénicos con valores de endorfina elevados o con síntomas de tipo catatónico. Sin embargo, la administración de 10-20 mg de naloxona por vía intravenosa no corroboró en general esta hipótesis.
Colecistoquinina (CCK)
La colecistoquinina es un péptido de 33 aminoácidos descubierto en 1928 en duodeno, yeyuno, íleon y colon, que produce aumento de las enzimas pancreáticas, contracción de la vesícula biliar e inhibición de la absorción en el intestino delgado.
En 1971, se comprobó que existen receptores en el sistema nervioso central donde actúa como modulador del metabolismo de la dopamina al reducir el turn-over de esta última en los núcleos candado y accumbens.
El derivado octapeptídico (CKK-8) fue aislado de estructuras mesolímbicas con acciones sobre el apetito, la glucemia, la hipotermia, la analgesia, la catalepsia y la hipófisis.
En 1981, se sintetizó un análogo del CKK-8 (aislado de la piel de sapos, en Australia) denominado ceruletide que, administrado en dosis de 0,3-0,6 mg/ kg por vía intramuscular, demostró tener efectos antipsicóticos. Sin embargo, estudios doble ciego en 265 enfermos esquizofrénicos demostraron una mejoría similar a la observada con placebos.
4) Fármacos coadyuvantes
a) Benzodiazepinas
Es conocida la psicovulnerabilidad de los pacientes esquizofrénicos frente a los sucesos traumáticos o a los cambios vitales (muerte de los progenitores o figuras sustitutas, separaciones, casamientos, nacimientos, etc.). Generalmente, la reacción es estresante, y produce una gran descarga de ansiedad que puede terminar en un brote psicótico agudo, como mecanismo defensivo frente a una realidad no tolerada por el enfermo. Si no se controla adecuadamente el episodio desencadenante, con medidas psicoterapéuticas que intervengan activamente en la problemática y con un tratamiento psicofarmacológico pertinente, la situación suele agravarse.
Este tipo de «ansiedad psicótica» es masiva y muchas veces difícil de diferenciar de la acatisia que presentan los pacientes que se encuentran en tratamiento con neurolépticos. En ambas, la inquietud y la permanente disconformidad psíquica, de no encontrarse satisfecho con nada, es progresiva, agregándose generalmente en la acatisia la imposibilidad de quedarse quieto y permanecer en un mismo lugar.
Durante mucho tiempo se han utilizado las benzodiazepinas para controlar este tipo de sintomatología, aunque, al mejorar la psicosis por producir sedación, se pensó que también eran eficaces en la esquizofrenia. Se ha podido demostrar que el diazepam administrado en dosis de hasta 40 mg/d puede mejorar la sintomatología psicótica en un 30 % de los enfermos esquizofrénicos, lo que equivale a una respuesta de tipo placebo. Con dosis superiores a los 100 mg/d pueden conseguirse mejorías del 33 % pero con efectos adversos, como ataxia y sedación. En cambio, si se administran benzodiazepinas juntamente con neurolépticos es posible disminuir la dosificación del antipsicótico. Así pudo reducirse de 560 mg/d a 265 mg/d de clorpromazina y al 47 % de la dosis de haloperidol en un grupo de pacientes que fue estudiado durante varios años en las admisiones de un hospital.
Por consiguiente, se puede afirmar que las benzodiazepinas son útiles en combinación con los neurolépticos para:
1) controlar las conductas ansiosas de enfermos esquizofrénicos, agresivos, hostiles y con excitación psicomotriz;
2) reducir las dosis de los neurolépticos administrados;
3) disminuir los efectos secundarios extrapiramidales de los antipsicóticos, en special la acatisia.
Sin embargo, se debe tener en cuenta que al incrementar las dosis de benzodiazepinas se pueden obtener dos tipos de respuestas: una conocida, con sedación y ataxia, y otra más rara con euforia, conductas agresivas e hiperquinéticas, que más que una «reacción paradójica» se debe interpretar como el equivalente al «switch maníaco» que se observa durante la administración de antidepresivos. En estos casos, se deberá prestar atención a los diagnósticos diferenciales entre esquizofrenia y trastornos afectivos.
La «neuroleptización o tranquilización rápida» con dosis altas de neurolépticos en pacientes agresivos y violentos, en quienes es necesario conseguir una rápida sedación, no dio los resultados esperados. A los clásicos efectos adversos de los antipsicóticos (hipotensión, sedación o síndromes extrapiramidales) se agregaron efectos secundarios muy peligrosos (distonía laringoesofágica y síndrome neuroléptico maligno). Estos inconvenientes hicieron preferible la administración de benzodiazepinas asociadas a neurolépticos en este tipo de pacientes.
Se puede intentar la administración de 1-4 mg de lorazepam por vía intramuscular en el día, o aprovechar la rápida absorción por vía oral del diazepam que, al metabolizarse a desmetildiazepam, permite una acción sostenida durante las primeras 48-96 horas, lapso durante el cual los neurolépticos en las dosis usuales no pueden actuar. No es conveniente administrar el diazepam por vía intramuscular o intravenosa, ya que por su alto poder lipofílico forma cristales en soluciones acuosas, y puede ocasionar irritaciones musculares o tromboflebitis.
Se puede intentar administrar 10-20 mg de diazepam cada hora por vía oral hasta controlar los síntomas agresivos, vigilando al paciente y teniendo en cuenta la sedación y ataxia que esta droga puede ocasionar.
b) Clonidina
La eficacia terapéutica demostrada clínicamente por fármacos antinoradrenérgicos (beta-bloqueantes, clonidina) en el tratamiento de enfermos psicóticos agresivos hizo pensar que la esquizofrenia podría interpretarse no sólo como un trastorno neuroquímico por hiperactividad dopaminérgica sino también catecolaminérgica.
También pudieron tratarse eficazmente con clonidina algunos enfermos que tenían disquinesia tardía, alteración extrapiramidal clásicamente atribuida a una supersensibilidad postsináptica de los receptores dopamínicos, producida por el bloqueo dopaminérgico de los neurolépticos.
El locus coeruleus, situado en la protuberancia, es una estructura con gran cantidad de neuronas productoras de noradrenalina y posee numerosos receptores opiáceos (mu, kappa, sigma). Este núcleo es activado por la ansiedad, el miedo y la deprivación de sustancias adictivas opiáceas (morfina, meperidina, heroína, etcétera) y es inhibido por la clonidina y los neuropéptidos opiáceos (que actúan sobre los receptores mu).
La clonidina puede, además, inhibir la actividad noradrenérgica provocada por la estimulación eléctrica de la vía que se origina en el locus coeruleus y que termina en las células de Purkinje del cerebelo de la rata.
El síndrome de abstinencia por opiáceos provoca descargas noradrenérgicas con el aumento del turn-over de noradrenalina, producido por la hipersensibilización postsináptica (up regulation). En condiciones normales, esta descarga simpática se encuentra inhibida por los neuropéptidos opioides (o endorfinas endógenas) que, al faltar en los síndromes de deprivación, origina los fenómenos clínicos de hipersensibilidad del sistema simpático (sudoración, taquicardia, hiperpnea, etc.).
La clonidina produce los siguientes fenómenos neuroquímicos:
1 ) Reduce los disparos de las células noradrenérgicas, actuando sobre los autorreceptores presinápticos.
2) Deprime la actividad de los receptores alfa-1 y beta-adrenérgicos postsinápticos.
3) Estimula el receptor alfa-postsináptico (agonista) .
4) Libera, por acción agonista sobre el receptor alfa-2, hormona de crecimiento, aun en niños con déficit de crecimiento.
Estas acciones llevaron a tratar de demostrar la eficacia clínica de la clonidina en:
1) Síndrome de abstinencia opiácea, alcohólica, tabáquica y de otras sustancias no claramente adictivas (benzodiazepinas).
2) Crisis maníaca.
3) Crisis de ansiedad generalizada con crisis de pánico.
4) Esquizofrenia.
La clonidina y otros análogos como la lofexidina y el guanabenz son utilizados en el síndrome de abstinencia de los opiáceos (morfina, meperidina, heroína, etc.), luego de la deprivación terapéutica y antes de iniciar la terapéutica con antagonistas opiáceos como el naltrexone (Trexan, EE.UU.), que a diferencia de la metadona no produce fenómenos de adicción o abstinencia.
Esta característica antinoradrenérgica -usada en clínica médica como antihipertensivo- se extendió al tratamiento de cualquier síndrome de abstinencia con hiperactividad simpática (metadona, propoxifeno, meprobamato, alcohol, tabaco, benzodiazepinas, etc.).
El 20-25 % de los enfermos esquizofrénicos no responde a la medicación con neurolépticos. La clonidina resultó eficaz en el mejoramiento de un grupo de pacientes resistentes al tratamiento con neurolépticos, actuando tanto sobre los síntomas psicóticos positivos (delirios, alucinaciones) como sobre los negativos (abulia, dificultad a la verbalización). Las dosis usadas fueron de 0,25 a 0,9 mg/d.
Los efectos adversos más importantes son hipotensión arterial, sedación, sequedad de boca, edemas de tobillo y síndromes de deprivación con exacerbación de la psicosis o de las crisis hipertensivas, cuando se la suspende bruscamente.
También se ha usado la clonidina con neurolépticos y litio para el tratamiento de los episodios maníacos y en los ataques de pánico. Inhibe las crisis de pánico provocadas por la infusión intravenosa de lactato; se desaconseja asociarla a antidepresivos, debido a que antagoniza sus efectos, cuya eficacia ya ha sido demostrada en estas alteraciones.
C) Beta-bloqueantes
El uso de beta-bloqueantes para atenuar los síntomas de ansiedad de tipo cardiovascular llevó a algunos investigadores a creer que el bloqueo de receptores de tipo beta-1 o beta-2 podría ocurrir también en el sistema nervioso central.
Sin embargo, no ha podido comprobarse que exista un receptor beta-1 (equivalente al que provoca la estimulación cardíaca periférica) o beta-2 (equivalente al que provoca la estimulación de la vasodilatación periférica) que estimule la producción de dopamina. El uso del propranolol (beta-bloqueante) en pacientes ansiosos no elimina el componente psíquico de la angustia, pese a que sí se pueden controlar las molestias cardiovasculares (taquicardia, eretismo cardíaco, etc.).
La administración, en estudios piloto, de 80 a 2400 mg de propranolol a pacientes esquizofrénicos, como medicación única o en combinación con neurolépticos, no consiguió demostrar su eficacia.
Sin embargo, se los debe considerar para pacientes esquizofrénicos que responden pobremente a los neurolépticos.
Su utilidad y eficacia pudieron ser demostradas en enfermos agresivos, con ataques de ira y violencia, que pueden ser dementes o con retardo mental, pero no necesariamente psicóticos.
No se puede atribuir su acción exclusivamente a sus efectos periféricos, ya que el nadolol atraviesa rápidamente la barrera hematoencefálica por su liposolubilidad.
Durante su administración, dada la necesidad de dosificarlo de forma elevada, se deben vigilar los efectos hipotensivos y bradicardizantes, y los antecedentes de enfermedad vascular periférica o pulmonar (bronquitis, asma, etc.).