Volver a ¨Psicofarmacología – Psicodinámica IV (Indice General)¨
Psicofármacos antipsicóticos
3-1. Esquizofrenia
En la psicofarmacoterapia de la esquizofrenia, es recomendable considerar diferentes criterios psico-neuro-biológicos, con el fin de no abrir expectativas mágicas, sino las más adecuadas para cada paciente en particular.
Desde 1900, época en la que Kraepelin describió por primera vez la clínica de la demencia precoz, hasta el día de hoy, en que Crow establece las diferencias sintomatológicas y neuroquímicas de las esquizofrenias I y II, sigue siendo difícil su diagnóstico.
El enunciado propuesto por el DSM IV no alcanza para definir pronósticos ni conflictos intrapsíquicos, pese a que contribuyó a sistematizar la enfermedad.
El diagnóstico actual debería incluir los criterios:
1 ) fenomenológico o sintomático
2) conflictos intrapsíquicos
3) estructural
4) bioeléctrico
5) neuroquímico
6) psicofarmacoterapéutico
importantes para poder tratar adecuadamente a los pacientes psicóticos, ya que el criterio farmacológico variará según los síntomas sean en más (productivos), en menos (interfieran en la sociabilidad y/o los déficit ocupacionales), agudos (crisis), crónicos (profilaxis), etc.
Aspectos sintomatológicos
Eugen Bleuler (1857-1939) estableció, al igual que Kraepelin, el diagnóstico de esquizofrenia basado en los signos deficitarios y no en los síntomas productivos, o positivos de la actual nomenclatura. Así, los síntomas patognomónicos fueron alteraciones en:
1) las asociaciones
2) los afectos
3) el fenómeno del autismo, y
4) la ambivalencia afectiva
Todos ellos contribuyen a una escisión mental que separa al enfermo de la realidad.
El hijo de Bleuler, Manfred, agregó a los síntomas anteriores otros dos:
5) la carga genética por sí sola no es patológica, siendo necesaria la aparición de factores estresantes para desencadenar la enfermedad, y
6) el paciente es quien «toma la decisión» de aislarse del mundo social.
Fue Kurt Schneider, en 1930, época que hacía referencia a los diferentes tipos de personalidad, quien remarcó la importancia de los síntomas positivos (alucinaciones y delirios) para el diagnóstico de esquizofrenia.
Estas categorías diagnósticas fueron luego incluidas en el DSM II y III. De esta forma, el diagnóstico de esquizofrenia y no de síndrome -como fue el de Bleuler- incluyó, para la escuela norteamericana, seis grupos de ítemes, de los cuales cinco corresponden a síntomas positivos y uno solo a trastornos del pensamiento.
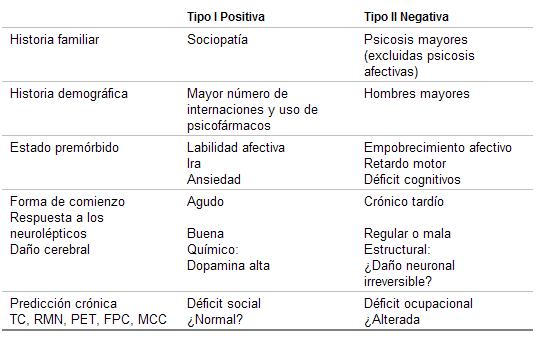
Fue Crow, a partir de 1980, quien correlacionó las características de los síntomas positivos con la estructura y neuroquímica cerebral.
Cuadro 1. Correlaciones clínicas y neuropatológicas de las esquizofrenias tipos I y II.
(Modificado de Crow)
Las recientes investigaciones neurofisiológicas sobre esquizofrenia tienden a dar, a la diferenciación hecha por Bleuler, un renovado interés. La modificación de que los síntomas primarios podrían ser entendidos como un disturbio básico del proceso de información y de integración cognitiva-funcional. Por lo tanto los delirios y las ideas paranoides podrían considerarse disfunciones cognitivas.
El delirio es esencialmente una equivocada e ¡lógica manera de pensar, y las ideas paranoides podrían entenderse como el resultado de focalizar la atención en donde otros verían aspectos intrascendentes.
Aún la alucinación ha sido entendida desde la teoría del procesamiento de la información.
Ultimamente se ha centralizado el estudio de la esquizofrenia en estos dos aspectos deficitarios: atención y procesamiento de la información. También estas disfunciones se interrelacionarían con otros centros que coordinan la atención, según la localización del estímulo visual y el lenguaje.
Se acepta que para una normal cognición se requiere una adecuada interacción entre el procesamiento del estímulo actual y la memoria almacenada de estímulos previos: información contextual (espacial y temporal), activación controlada y apropiada del material almacenado, variabilidad de respuesta, etc.
La función del hipocampo parece particularmente relevante para el modelo de cognición, ya que contribuirá al establecimiento de relaciones entre estímulos: espacio-tiempo, adentro-afuera, actual-pasado, etc.
Una implicancia terapéutica de estas conclusiones sería la siguiente:
Si el delirio esquizofrénico es secundario a un trastorno básico del proceso de información es posible encontrar drogas que corrijan el delirio sin influir sobre el trastorno básico. Desde que el efecto antidelirante de los antipsicóticos es correlativo al bloqueo de D2, es pertinente afirmar que la hiperactividad dopaminérgica está asociada al delirio, pero no al trastorno básico del proceso de información.
Sería interesante, entonces, buscar un tratamiento que actuara en ambos niveles y que corrigiera ambas situaciones, primaria y secundaria.
Se ha dicho que la esquizofrenia no debe ser entendida como una entidad homogénea, sino como un síndrome que puede incluir complejos variables en cuanto a su etiología y fisiopatología.
Ningún factor etiológico aislado pudo ser considerado como necesario y/ o suficiente.
El factor hereditario es un ejemplo. Nadie duda que existen factores genéticos que contribuyan en la producción esquizofrénica, pero este factor no está presente en todos los casos; aún más, si el rasgo de concordancia para esquizofrénicos en gemelos homocigotas es más alto que en gemelos heterocigotas, no llega a ser del 100 %. Esto parece indicar que el factor genético puede a veces ser un factor etiológico suficiente, mientras que en otros casos sólo es un factor contribuyente, y aunque las anormalidades cromosómicas existen, probablemente no sean relevantes en una razonable cantidad de pacientes.
Hay muchas discrepancias y hallazgos controvertidos en esta área.
Existen muchos hallazgos anatómicos y morfológicos relacionados o que se han relacionado con esta enfermedad:
1) Reducción del volumen craneal total.
2) Reducción de los lóbulos temporales, frontales, cerebelo (especialmente el Vermis).
3) Atrofia de los ventrículos (3′ y laterales), a veces en la fase temprana de la enfermedad (en especial en el tipo II).
4) Atrofia de áreas corticales, frontales y/o temporales.
5) Asímetría cerebral total o parcial (normalmente el lóbulo frontal derecho y el frontal izquierdo son más grandes).
6) El lóbulo izquierdo aparece más afectado que el derecho.
7) Anormalidades neuronales:
a) densidad reducida en zonas corticales, compensada por un aumento de la glia, y
b) alteraciones a nivel de la de las células piramidales del hipocampo.
Estas alteraciones se atribuyen al trastorno del desarrollo, más que a lesiones degenerativas. Las mismas se producirían entre el segundo y tercer mes de gestación, por trastornos migratorios desde las capas profundas corticales.
Todas estas alteraciones no se encuentran en todos los pacientes y en algunos de ellos ninguna de éstas está presente. La evidencia más clara parece ahora centrarse en el hecho de que muchos pacientes esquizofrénicos sufren de un defecto en el desarrollo cerebral, lo cual puede deberse a un solo factor, el genético, por ejemplo, o quizás más frecuentemente a una combinación o a tina interacción entre factores genéticos y ambientales.
Las anormalidades morfológicas son más frecuentemente observadas en las formas simple, hebefrénica o desorganizada. Éstos son subtipos de enfermedad esquizofrénica caracterizados por un pobre funcionamiento premórbido, comienzo precoz, síntomas negativos y respuesta antipsicótica insatisfactoria (tipo II). Las anomalías morfológicas son menos frecuentes de encontrar en la forma paranoide, con mejor funcionalidad premórbida (tipo I).
¿Qué implicancias tienen estas alteraciones morfológicas en relación con el tratamiento, y en el posterior curso de la enfermedad esquizofrénica?
Probablemente la implicancia más obvia sea el signo negativo. Por el momento no existen medios de recomponer defectos innatos en el número de neuronas y/o sus conexiones.
Estas alteraciones ponen un límite a las posibilidades de mejoría funcional, que se puede obtener con medidas farmacológicas u otros tipos de tratamientos biológicos o psicosociales. Este techo, que representa groseramente el funcionamiento premórbido del paciente, puede progresar en distintas direcciones, teniendo en cuenta otros factores concomitantes que influyen sobre él.
La educación, el entrenamiento asertivo, el abordaje psicoterapéutico, etc., pueden compensar, en cierta medida durante bastante tiempo, lo que por otro lado no podemos ignorar: que en muchos casos, tal vez la mayoría, el defecto es progresivo llevando a la atrofia cortical.
Sabiendo que un adecuado abordaje de la enfermedad puede retardar o detener el efecto progresivo es muy importante instituir el tratamiento tan pronto como sea posible. Hay indicadores que demuestran que el tratamiento iniciado precozmente se asocia a una mejor respuesta aguda y a un mejor pronóstico a largo plazo.
Sin embargo, este hecho tampoco es inequívoco: hay pacientes con comienzo insidioso, progresivo deterioro e inherente mal pronóstico, que pueden responder favorablemente al tratamiento en el largo plazo, mucho más que pacientes con comienzo agudo, dramático en lo que esperaríamos mejor pronóstico.
Existe otro aspecto importante referido a la progresión de la esquizofrenia:
¿podríamos prevenir la progresión del defecto primario actuando terapéuticamente en el período comprendido entre el nacimiento y la maduración cerebral?.
La evidencia señala que una adecuada estimulación temprana puede modificar estructura y función. Hay una positiva correlación entre la riqueza y la complejidad del ambiente en el primer período de vida y la capacidad final del complejo desarrollo cerebral, no sólo funcionalmente sino también morfológicamente.
Entonces, es razonable asumir que el defecto primario de la estructura y funcionamiento cerebral en los niños pre-esquizofrénicos los lleve a tener una pobre interacción con el ambiente y a una menor estimulación positiva de éste, llevándolos a un círculo vicioso con efecto negativo sobre la maduración cerebral. Esta consecuencia podría prevenirse con un ambiente emocional, cognitivo e intelectualmente rico, antes de que el cerebro alcance su complejo desarrollo; llegado a este punto ya es tarde. Ésta no es una idea novedosa, lo que tal vez sea novedoso es el hecho de que el contexto influya a un nivel más profundo, el morfológico.
Las versiones nuevas del DSM-IV y del ICD-10 incluyen la presencia de síntomas negativos para el diagnóstico de esquizofrenia y en el DSM-IV:
1 ) delirios
2) alucinaciones
3) desorganización al hablar
4) conducta catatónica
5) síntomas negativos (embotamiento afectivo, alogia y pérdida volitiva).
El tiempo de duración de los síntomas se acortó a un mes (cuando antes se exigían seis) y aun a menos si los síntomas han sido tratados satisfactoriamente.
Ahora, en el DSM-IV se exigen dos ítemes para hacer el diagnóstico de esquizofrenia, y uno solo si los delirios son bizarros o las alucinaciones auditivas.
Los síntomas positivos, negativos y mixtos pueden agruparse como síndromes, como se observa en los siguientes cuadros (2, 3 y 4):
Cuadro 2. Síntomas positivos de la esquizofrenia tipo I
A) Uno de los siguientes síntomas predomina:
(La severidad se considera según la persistencia, frecuencia y efectos sobre el estilo de vida.)
1) Alucinaciones severas dominan el cuadro clínico.
2) Delirios severos (persecutorios, hipocondríacos, etc.)
3) Alteración marcada de] pensamiento abstracto.
4) Conductas bizarras y desorganizadas.
Cuadro 3. Síntomas negativos de la esquizofrenia tipo II
A) Uno de los siguientes síntomas está presente de forma marcada:
1 ) Alogia (falta de espontaneidad y fluidez en el pensamiento y la conversación).
2)Anhedonia (pérdida del placer, escaso contacto social).
3)Embotamiento afectivo (falta de fluidez para expresar emociones).
4) Pérdida volitiva (pérdida de la habilidad para empezar y terminar las tareas. Apatía, anergia).
5) Déficit atencional.
Cuadro 4. Síntomas de la esquizofrenia tipo mixto (Andreasen)
Se incluye en esta categoría a pacientes que:
1) no encuadran en los criterios del tipo I o positiva;
2) no encuadran en los criterios del tipo II o negativa;
3) tienen criterios de ambos tipos.
Las escalas que evalúan los síntomas positivos y negativos han podido demostrar que los pacientes esquizofrénicos poseen mayores puntajes de síntomas positivos y negativos que los enfermos maníacos y que los depresivos.
Esto sustenta la hipótesis de que es muy difícil atribuir síntomas específicos a un determinado desorden psicótico. Síntomas delirantes y alucinatorios se presentan en enfermos maníacos y síntomas negativos aparecen en pacientes depresivos (ver escalas en cap. 1, 1-27).
Cuatro años después de haber recibido neurolépticos convencionales, según la diferenciación por las escalas de síntomas negativos y positivos, se concluye que los síntomas positivos disminuyen en un 50 %, en tanto que los síntomas negativos sólo lo hacen en un 21 %.
Existe una gran estabilidad de la dimensión de síntomas negativos comparada con la de síntomas positivos y con el síndrome desorganizativo, El síndrome negativo se ha relacionado con un déficit dopaminérgico, en la corteza prefrontal dorsolateral, con reducido flujo sanguíneo (más del lado izquierdo que del derecho), y evidencias neurológicas de apraxia y otros importantes déficit de tipo motor.
Con RMN se ha evidenciado que el incremento de líquido cefalorraquídeo, se correlaciona más con los síntomas positivos y negativos, que con la desorganización. La reducción de la sustancia gris en hipocampo y amígdala se ha correlacionado con el síndrome desorganizativo, mientras que cambios similares en el girus temporal superior se correlacionan con síntomas positivos.
¿Tienen estas conclusiones importancia para el pronóstico?
¿Se puede advertir, a la luz de estos conocimientos, a los miembros de la familia -de modo temprano- que deberán organizarse para cuidar del enfermo, que tendrá dificultades para obtener trabajo, ganar dinero, ser independiente y relacionarse con amigos?
Si no se aplican las alternativas farmacológicas (ya que las sociales aquí no se tratan), la respuesta es afirmativa, y aun el alivio sintomático en beneficio del enfermo, la familia y la sociedad no implica una garantía de adecuación sociolaboral.
La combinación de trastornos «esquizofrénicos menores» (esquizotípicos, esquizoafectivos y fronterizos) con patología de los grupos marginales (abusadores de sustancias adictivas, sociopatía de los «sin casa» (homeless) con y sin agresividad) será la regla.
Aún queda sin explicación por qué algunos enfermos no tienen recaídas aunque se les suprima la administración de fármacos antipsicóticos.
Cuando se analizaron, sobre un total de 3500 enfermos, 35 estudios de pacientes esquizofrénicos que habían recibido placebo y tratamientos con neurolépticos durante un lapso que osciló desde dos meses hasta dos años, se observó que rebrotó el 57,6 % bajo placebo y solamente el 16,7 % a los cuales se les habían administrado antipsicóticos. Las recidivas también aparecen en el grupo tratado, pero de forma mucho más paulatina a lo largo del tiempo.
Por el contrario, los síntomas negativos de comienzo empeoran de manera gradual, en especial la anhedonia y los correspondientes a la volición.
Son conocidos los estudios que han demostrado alteraciones en el SNC (81) a través de la neumoencefalografía, la tomografía computada (TC) y la resonancia magnética nuclear (RMN) cerebral simple, ecoplanar y espectroscópica (cuadro 1).
Estos hallazgos pudieron confirmarse con RMN en 15 pares de gemelos monocigóticos, de los cuales uno de cada par había desarrollado esquizofrenia.
La RMN del hermano sano se tomó como normal o comparativa, y al compararla con la del hermano enfermo se pudieron apreciar alteraciones en el volumen cerebral y ventricular.
Algunos autores atribuyen estas lesiones a un defecto de migración neuronal en las primeras semanas de la gestación por alguna noxa. Factores neuropatológicos desconocidos, durante el transcurso de la vida, incidirían en la aparición de la enfermedad.
Recientemente con la tomografía de emisión positrónica (PET) -permite incorporar por vía intravenosa sustancias radiomarcadas breves, emisoras de positrones cuya colisión con electrones circulantes produce fotones gamma que al ser captados por detectores de centelleo producen una representación tridimensional de la actividad radiactiva- se ha podido aclarar la localización de diferentes neurotransmisores, receptores dopaminérgicos y fármacos que los
ligan.
La tomografía por emisión de fotones (SPECT), si bien tiene menor definición para observar las estructuras subcorticales, es más asequible, ya que las sustancias marcadas radiactivamente tienen una vida más larga, y mediante una cámara centellográfica se captan las radiaciones emitidas por un solo fotón.
El defecto del desarrollo cerebral se refleja en los mecanismos cognitivos y en el procesamiento de la información recibida.
Son varias las regiones anatómicas cerebrales involucradas en estos procesos pero la corteza prefrontal es quizás la más importante de la región, pues abarca la tercera parte de toda el área cortical. La gran sofisticación de esta área, especialmente en el hemisferio izquierdo, reside en su relación con el lenguaje y constituye el rasgo de mayor diferenciación del cerebro humano, respecto de otros animales de la escala inferior.
La corteza prefrontal es un área de masivas conexiones y se han descripto distintos hallazgos en pacientes esquizofrénicos:
a) Metabolismo frontal o prefrontal reducido.
b) Reducción general del metabolismo cerebral.
c) Relativo hipermetabolismo izquierdo.
d) Relativo hipemietabolismo de lóbulos temporales.
e) Anomalías funcionales a nivel de globus pallidus izquierdo.
La corteza prefrontal tiene conexiones recíprocas con todas las áreas del neocórtex (temporales, parietales y occipitales), también con regiones límbicas como el girus cingular y el hipocampo. Estas conexiones reciben todas las modalidades de impulsos: los sensoriales (auditivos, espaciales y visuales) y los de los de centros de la emoción y la atención.
La corteza prefrontal integra la información recibida y provee respuestas, a su vez moduladas por funciones corticales superiores. Recibe información ascendente del tálamo, que a su vez le llega, desde ciertas regiones de los lóbulos temporales.
Se han identificado tres regiones prefrontales especializadas:
1. Dorsolateral: al servicio de funciones cognitivas (abstracción);
2. Orbital: al servicio de funciones de enjuiciamiento y sociabilidad, y
3. Medial. relacionada con la actividad y con la voluntad.
La función de esta zona, mediatizada por neurotransmisores, está relacionada con la posibilidad de monitorear, de comprender, de priorizar y de llevar a cabo otras funciones ejecutivas.
Por el momento, desde una concepción teórica pura, parece difícil seleccionar un correcto abordaje psicofarmacológico. Seguramente haremos abordajes erróneos que deberemos corregir sobre la marcha.
El mapeo cerebral computarizado (MCC) también da información acerca de la bioelectricidad ya que puede mostrar el aumento de las ondas delta, que se puede interpretar como un índice de hiperexcitabilidad cerebral. Esta alteración de «filtro» del tronco cerebral podría ser una alteración de la relación dopamina/acetilcolina en el cerebro de los esquizofrénicos.
En conclusión se puede afirmar que:
1) el agrandamiento de los surcos implica tina atrofia cortical, que no siempre está asociada a
2) dilatación ventricular, que significa una atrofia subcortical.
Con el tiempo, los pacientes con síndrome de tipo I pueden progresar al tipo II, y durante su curso algunos pierden definitivamente los síntomas positivos. Los pacientes con síntomas negativos, en general, se estabilizan en el síndrome una vez que remiten los síntomas positivos, especialmente aquellos que presentaron esquizofrenia hebefrénica.
Aspectos neuroquímicos
En los últimos años se ha visto la inconsistencia de la hipótesis hiperdopaminérgica de la esquizofrenia.
Ello se debe a que:
1) las drogas que aumentan la dopamina no producen esquizofrenia, pero empeoran los síntomas en pacientes esquizofrénicos;
2) existen pacientes con resistencia al tratamiento neuroléptico, demostrado por:
a) la saturación de receptores dopaminérgicos, corroborada por la PET Los receptores dopaminérgicos se saturan con niveles de 5 a 15 ng/ml de haloperidol plasmático. A partir de los 20 ng/mI la curva de saturación se convierte en asintótica, sin lograrse mayor saturación del receptor dopaminérgico (25);
b) los neurolépticos sólo mejoran en forma parcial los síntomas negativos después de la fase aguda;
3) existen en los estudios necrópsicos corticales zonas de hipodopaminergia cortical que pueden correlacionarse con síntomas negativos. Correlativamente se observan zonas de hiperdopaminergia subcortical;
4) existe relación entre síntomas negativos y disminución del ácido homovanílico en el LCR y plasma. Este último expresa la alteración del metabolismo dopamínico;
5) deben estar involucrados otros sistemas neuroquímicos en el trastorno esquizofrénico;
a) en el sistema serotoninérgico (5-HT), dosis altas de triptófano,
triptamina o LSD provocan estados comparables a la desintegración esquizofrénica. Existen antagonistas selectivos (5-HT2), como ketanserina y ritanserina, que inhiben estos síntomas experimentales y clínicos;
b) las endorfinas están implicadas en la esquizofrenia.
Se puede producir mejoría de algunos síntomas con la eliminación de endorfinas por hemodiálisis o con un nuevo antagonista opiáceo, namelfene, similar a la naloxona. También se ha logrado en algunos casos cierta mejoría con el neuropéptido (CCK-8), similar a la colecistoquinina -aislada del tubo digestivo y en el cerebro-, que interactúa con la dopamina.
Se sigue investigando el equilibrio entre endorfinas alfa y gamma, ya que al administrar esta última se pueden mejorar ciertos síntomas esquizofrénicos.
El sistema dopamínico está compuesto por tres subsistemas: nigroestriado, mesolímbico (llamado A9) y mesocorticolímbico (llamado A10). Este último es el más importante desde el punto de vista sintomatológico, ya que comunica el sistema extrapiramidal y el límbico con la corteza frontal.
La administración crónica de neurolépticos produce un bloqueo por despolarización postsináptica en ambos sistemas. Sin embargo, la clozapina bloquea con mayor intensidad el área tegmental ventral, donde se origina la vía mesocorticolímbica. De allí los menores efectos extrapiramidales de este neuroléptico, llamado atípico por esta razón.
El receptor dopamínico, al igual que otros receptores, existiría de dos formas:
– una forma con alta afinidad por los agonistas (DA1) asociada a la adenilciclasa, cuya estimulación produce un aumento del AMP cíclico. Se lo encuentra en la corteza y el sistema límbico (DA1A y DA1B/DA5);
– una forma de alta afinidad por los antagonistas (DA2), que no está asociada a la adenilciclasa y se une al H3-haloperidol. Se lo localiza principalmente en el sistema nigroestriado, con dos subtipos (D3 y D4) de localización corticolímbica.
De reciente descubrimiento son los receptores DI y D5. El DI presenta una gran afinidad con la clozapina, y el D5 es similar al DI, pero tiene una alta afinidad con la dopamina.
Lo que interesa es el bloqueo dopamínico de la zona A10 como mecanismo de acción cortical de los antipsicóticos,
Los neurolépticos inhiben clásicamente las acciones de la apomorfina (estimulante directo de los receptores dopamínicos), de la anfetamina (estimulante indirecto), de la cocaína (inhibe la recaptación de la dopamina) y de la cafeína (que es un inhibidor de la fosfodiesterasa que impide la degradación del AMP cíclico estimulado por la dopamina).
La inhibición sobre la apomorfina y la anfetamina es lo que caracteriza químicamente a los neurolépticos típicos.
Cuando existen otras propiedades neurofarmacológicas se los denomina atípicos, aunque desde el punto de vista clínico se los llame así porque no ocasionan fenómenos extrapiramidales,
La hipofunción prefrontal en la esquizofrenia está asociada a una baja actividad dopamínica, El aumento del flujo plasmático prefrontal mejora cuando se administran agonistas dopaminérgicos -como la anfetamina y la apomorfina- y se realizan pruebas o tests de sobrecarga psicológica de forma simultánea.
Esta demostración de hipodopaminergia cortical con hiperdopaminergia subcortical da lugar a numerosos interrogantes.
Las lesiones corticales podrían tener como correlato el aumento de dopamina subcortical? Este tipo de alteración se puede observar en estudios experimentales y en pacientes con lesiones prefrontales.
Los síntomas negativos se relacionan con una menor actividad dopamínica frontal. El ácido homovanílico aparece disminuido en el LCR y plasma, y el flujo plasmático prefrontal es menor durante las actividades intelectuales.
Los síntomas positivos están relacionados con altos niveles de dopamina en el área A10. Los niveles de ácido homovanílico son altos y existe una buena respuesta al tratamiento con neurolépticos típicos o convencionales.
Un neurotransmisor interesante es el glutamato que ejerce su acción sobre el receptor NMDA (N-metil-D-Aspartato).
El mecanismo glutamatérgico-aspartégico ejerce una poderosa influencia excitatoria sobre la vía corticoestriada que a su vez inhibe a la formación reticular y a las vías talámicas.
Consecuencia de esta inhibición, la información sensorial a través del tálamo sufre un mecanismo de «filtro», antes de arribar a la corteza. Así, el alerta inducido por estímulos, tanto del medio externo, como del propio cuerpo, es minimizado. Si el flujo de información que alcanza la corteza cerebral resulta excesivo, la capacidad interativa cortical puede fracasar y aparecer síntomas psicóticos como delirios, compulsiones impulsiones u otros.
Existe un balance entre las terminales excitatorias glutamatérgicas y las terminales inhibitorias dopaminérgicas sobre la regulación de la actividad de neuronas gabaérgicas en el cuerpo estriado. Esto tiene una crucial importancia en la función filtro del tálamo que parece ser hipoactivo en la esquizofrenia.
La hiperactividad de la dopamina o la hipoactividad del glutamato pueden reducir la acción del GABA y producir un efecto negativo sobre la función de filtro de la información sensorial, que realiza el tálamo.
La hipoactividad de las neuronas GABA puede mejorarse reduciendo la actividad dopaminérgica o estimulando la actividad glutamatérgica.
Sin embargo. si el defecto primario es la hipoactividad de los receptores NMDA, parecería más racional estimular a los primeros y no inhibir la hiperactividad dopaminérgica.
Una de las razones para implicar a los receptores del sistema NMDA en la esquizofrenia es el efecto símil-esquizofrénico, que produce el bloqueo de receptores NMDA por la sustancia adictiva fenilciclidina (PCP o polvo de ángeles), que induce en pacientes esquizofrénicos un dramático rebrote de la enfermedad.
Estas observaciones hacen suponer que la vía corticoestriada glutamatérgica-aspartérgica, puede estar comprometida en la patogénesis de la esquizofrenia y otras condiciones psicóticas como la manía y los estados confusionales.
Otro antagonista del receptor NMDA, es el MK-801, cuya acción produce una inducción de la motilidad en ratas, que se puede potenciar con el agregado de clonidina (agonista del receptor alfa-2 noradrenérgico). Dicha potenciación ha mostrado ser resistente a los clásicos neurolépticos, pero no a la clozapina.
La eficacia de la clozapina también puede explicarse por la acción antiadrenérgica, que puede potenciar la acción bloqueante del receptor dopamínico.
Otra reciente y notable observación es la habilidad de la clonidina, en combinación con atropina, para inducir la motilidad en ratones deplecionados de dopamina. Esta motilidad difiere de la producida por MK-801: mientras esta última produce locomoción anormal sólo en las patas delanteras del animal, la inducida por clonidina más atropina logra una actividad motora exploratoria normal.
Estas observaciones sugieren que la influencia del sistema glutamatérgico-aspartérgico sobre la actividad psicomotora es selectiva, ya que la dopamina no juega un rol decisivo en la regulación de dicha actividad.
Ha habido intentos de estimular los receptores NMDA en la esquizofrenia, por ejemplo con glicina, pero no se han obtenido resultados convincentes. Un problema es que la estimulación intensa de los receptores NMDA puede provocar la muerte neuronal por la entrada masiva de iones calcio a la célula.
Actualmente se trata de desarrollar «drogas limpias» selectivas que actúen en sitios específicos, en lo posible sobre un receptor. Hay dos razones para esto: es más fácil evaluar el efecto de una «droga limpia» que el multiefecto de una «droga sucia» y usualmente la «droga limpia» provoca menos efectos secundarios indeseables.
Luego de la droga «sucia» clorpromazina, se desarrollaron bloqueadores dopaminérgicos más selectivos como el haloperidol, la pimozida y otros. Este desarrollo permite usar drogas con menores efectos adversos pero no siempre con tan eficaz efecto terapeútico.
La cuestión es que la combinación produce una óptima mejoría de síntomas positivos y negativos en la esquizofrenia. Esta combinación se puede lograr con drogas relativamente nuevas (atípicas), como la clozapina, risperidona u olanzapina y otras veces se deberá combinar con drogas gabaérgicas como son la benzodiazepinas, anticonvulsivantes, atiticíclicos, etc.
Parece tener importancia para la mejoría, el bloqueo de receptores D2, pero aun un bloqueo acentuado de estos receptores puede tener un efecto negativo sobre los síntomas. Ésta es tina de las razones para asumir que parece que hay más una hipo, que una hiperfunción de los sistemas dopaminérgicos en la corteza frontal de los pacientes esquizofrénicos, mientras que habría una hiperfunción en las estructuras subcorticales. Entre ambas zonas existe tina recíproca interacción y tal vez sea más importante encontrar el correcto balance entre ambos sistemas que obtener tina completa inhibición de ellos.
Se ha postulado que el bloqueo de receptores 5-HT2 es el efecto adicional más importante requerido para tina completa mejoría.
Los hallazgos neuroquímicos en el síndrome negativo son similares a la enfermedad de Parkinson (ver cap. 19).
Desarrollarán inevitablemente psicosis los enfermos con hipodopaminergia cortical?
Las diferencias de niveles dopamínicos entre, ambas estructuras serán capaces de originar la psicosis en enfermos esquizoides?
Se podrían mejorar estos pacientes, si se estimulan los receptores DA1 y DA5, al provocar de esta forma un feedback negativo sobre la hiperdopaminergia subcortical?
Sigue sin respuesta el interrogante de si el error metabólico en la transmetilación (ver cap. 1, 1-14) y la menor actividad de la MAO producirían la aparición de sustancias psicotóxicas en los homocigotos y, en consecuencia, la enfermedad clínica, en tanto que los heterocigotos desarrollarían características esquizotípicas según sea el entorno familiar y social.
Otras hipótesis neuroquímicas
La incidencia de esquizofrenia en la población general es de 1-2 %. En cambio, si uno de los progenitores es esquizofrénico, la posibilidad de adquirir la enfermedad se eleva al 7-16 %, y llega a ser del 40-68 % en el caso de que ambos padres la padezcan. La influencia que ejerce el medio familiar y social estaría demostrada por el hecho de que en los mellizos homocigotos (es decir, genéticamente idénticos), cuando la enfermedad se manifiesta en uno de ellos, la posibilidad de que el otro también la padezca es del 40-85 % y no del 100%.
Gran variedad de proyectos de estudios están concentrados en investigar qué porciones del genoma estarían involucrados en la esquizofrenia, cuál es la naturaleza de la asociación y cuál el mecanismo de acción. Marcadores posibles para esquizofrenia han sido identificados en el brazo largo del cromosoma 22 y en el brazo corto de los cromosomas 3, 6, 8 y 20 (ver cap. 18).
Se han demostrado alteraciones en el sistema de receptores de ciertos neurotransmisores, como por ejemplo en receptores 5-HT y D3 o con cierta repetición, anormalidades en el número de trinucleótidos. Sin embargo aún no se conoce con exactitud la naturaleza de estos hallazgos.
Dos neurotransmisores de la corteza, el GABA y el glutamato, han sido involucrados con la enfermedad. El glutamato es el principal neurotransmisor de las proyecciones neuronales que atraviesan las regiones de la corteza cerebral en donde los síntomas esquizofrénicos parecen originarse.
Los estudios de experimentación demuestran una fuerte interacción entre el glutamato con el GABA y la dopamina.
Es así que:
– la administración de drogas como la fenilciclidina (inhibidora del glutamato), produce síntomas similares a los de la esquizofrenia, en sujetos normales.
– estudios post-mortem de los receptores de glutamato, en pacientes esquizofrénicos, muestran anormalidades en la corteza prefrontal (se ha encontrado una reducida densidad de receptores de neurotensina y de colecistoquinina en neuronas glutamatérgicas localizadas en la corteza entorrinal de pacientes esquizofrénicos). Estos cambios sugieren tina desconexión neuroquímica del hipocampo con la zona entorrinal. Usando resonancia magnética espectroscópica, se ha encontrado una marcada reducción en la concentración de N-Acetyl-Aspartato, en el área rostral del hipocampo y la corteza prefrontal dorsolateral bilateral de pacientes esquizofrénicos, comparados con sujetos normales.
El GABA, principal neurotransmisor en la corteza cerebral, interactúa con la dopamina y el glutamato. Se ha visto incremento de la densidad de receptores GABA en tejidos post-mortem de pacientes esquizofrénicos, lo que indicaría un posible déficit del GABA. Por otra parte drogas que tienen efecto directo sobre el GABA no son efectivas en el tratamiento de la esquizofrenia.