Condiciones tempranas del desarrollo y el aprendizaje: el papel de las funciones ejecutivas
(S. Sastre-Riba)
Resumen. Introducción. Desde el neuroconstructivismo, el desarrollo cognitivo se entiende y estudia como proceso de reorganización sucesiva, al igual que sus mecanismos de cambio y sus resultados diferenciales. Los primeros años de vida son esenciales para explicar las competencias cognitivas, emocionales y sociales diferenciales.
En este proceso, los cambios en las funciones ejecutivas cumplen un papel esencial. Captarlos reclama una investigación interdisciplinar que relacione los datos neuroanatómicos cerebrales con datos funcionales y psicológicos. Objetivo. Conocer interdisciplinarmente el funcionamiento ejecutivo temprano en bebés con cursos diferenciales de desarrollo (bebés típicos, bebés con síndrome de Down, bebés con factores de riesgo al nacer). Postulamos la existencia de un gradiente diferencial temprano de funcionamiento ejecutivo. Sujetos y métodos. Se estudia, comparativa y longitudinalmente, la actividad de bebés típicos (n = 10), bebés con factores de riesgo (n = 6 bebés con hipotiroidismo congénito; n = 6 bebés con bajo peso al nacer) y bebés con síndrome de Down (n = 6), con un material de estímulo, a los 1,3 años y 9 meses después. Se realiza un doble análisis de datos cualitativo y cuantitativo. Resultados. Se obtienen diferentes patrones de funcionamiento ejecutivo temprano entre los grupos estudiados; la mayor diferencia se observa entre los bebés típicos y los bebés con síndrome de Down; los bebés con factores de riesgo ocupan un gradiente entre ambos, más cercano a los primeros, pero con ciertas diferencias. Se evidencia también el desarrollo de las funciones ejecutivas a lo largo de las edades estudiadas. Conclusión: Estas diferencias de funcionamiento ejecutivo proporcionan pautas de intervención para la armonización del desarrollo cognitivo temprano. [REV NEUROL 2006; 42 (Supl 2): S143-51] Palabras clave. Aprendizaje. Desarrollo temprano. Desarrollo típico y atípico. Flexibilidad. Función ejecutiva. Interacción. Lógica. Neuropsicología. Perseveración.
INTRODUCCIÓN
El concepto actual de salud ha incorporado la necesidad de diagnosticar e intervenir lo más tempranamente posible con el fin de prevenir cualquier factor o situación de riesgo que pudieran alterar el bienestar biopsicosocial del individuo.
Durante la década pasada, la investigación sobre el desarrollo humano avanzó hacia la interdisciplinariedad, intentando integrar los cambios conductuales y los cambios cerebrales subyacentes, particularmente los del neocórtex [1]. El panorama actual reclama elaborar teorías explicativas del desarrollo humano que permitan integrar la información sobre el desarrollo estructural (neuroanatómico) del cerebro con los conocimientos sobre la conducta cognitiva y sus cambios. Para ello, se centra la mirada en la maduración de las regiones frontales del cerebro, dado su lugar esencial en las funciones cognitivas superiores que regulan la conducta cognitiva, emocional y social del sujeto. Esta perspectiva ofrece la oportunidad de renovar la conceptualización sobre los cursos diferenciales del desarrollo (típico y atípico) y sobre las estrategias educativas, pero es preciso establecer un puente sólido entre los cada vez más numerosos resultados neuroanatómicos y los referidos al desarrollo funcional, sus correlatos conductuales y los posibles trastornos que aparecen en él.
Para ello, la neuropsicología actual parte de unos supuestos básicos: 1) La necesidad de la investigación interdisciplinar; y 2) El marco renovado del concepto de desarrollo, la existencia de competencias cognitivas tempranas en los recién nacidos y su importancia en el desarrollo cognitivo posterior.
Investigación interdisciplinar
La comprensión actual del desarrollo cognitivo reclama una investigación interdisciplinar y neuropsicológica [2-6] sobre la relación entre la arquitectura cerebral y el funcionamiento de los procesos cognitivos [2,5,7], en la que se contemple la continua interacción entre los genes, la estructura neuropsicológica y el contexto social [1,2]. Esta investigación, apoyada en técnicas de imagen cerebral, puede abrir nuevas vías de investigación y comprensión de los fenómenos diferenciales del desarrollo típico y atípico [8] para, a partir de aquí, intervenir adecuadamente en ellos.
En concreto, la neuropsicología del desarrollo investiga interdisciplinariamente las relaciones entre el desarrollo del cerebro y el desarrollo cognitivo. Su indagación acerca del desarrollo típico y atípico puede ofrecer aplicaciones prácticas para el diagnóstico temprano y la intervención efectiva en sus trastornos [4]. Asimismo, estudia los cambios neuronales que se producen durante el aprendizaje y cómo éste es determinado por la estructura y la funcionalidad del cerebro, a la vez que desempeña un papel central en la eliminación, selección o estabilización de las sinapsis, especialmente a lo largo de los primeros años [9].
* Marco renovado sobre el concepto de desarrollo.
El concepto de ‘desarrollo’ hoy deja de lado antiguas dicotomías como la de ‘natura y nurtura’ [4] y afirmaciones insostenibles como: a) su inicio desde el nacimiento, a partir de una estructura de reflejos; b) la necesidad de eludir la neurología con argumentos fisiologistas y mecanicistas; c) negar la multimodalidad del desarrollo; d) proclamar la estaticidad de la deficiencia mental; y e) la separación entre el desarrollo y el aprendizaje [10]. Responde a un modelo integrado en el que la ontogenia se entiende como una organización jerárquica sucesiva y ordenadamente emergente, con relaciones bidireccionales entre la complejidad biológica y la organización psicológica, incluyendo la actividad genética y la neurológica, la experiencia y el entorno.
No hay duda de que la estructura neural influye en las funciones psicológicas y el aprendizaje, y éstos, en aquélla.
Desde esta perspectiva, el desarrollo cognitivo se entiende como la transformación continua y diferencial [11] de estructuras y funciones cognitivas durante el ciclo vital, a partir de unas conductas preformadas y en interacción con el medio, durante la cual la mente humana emerge a partir de un cerebro en desarrollo [5]. En este proceso, la acción individual y la interacción social son componentes esenciales [6,12]; el interés reside no sólo en las capacidades cognitivas construidas y reconstruidas, sino también en su control, funcionamiento y manifestaciones diferenciales. En suma, la estructura cerebral, el desarrollo cognitivo y el aprendizaje están estrechamente imbricados en la sucesiva construcción intelectual y en sus manifestaciones. A lo largo de este proceso de redescripción continuada, la organización y el despliegue funcional de conductas van dando lugar a cursos de desarrollo armónicos o disarmónicos. La sucesiva transformación de éstos genera manifestaciones diferenciales que pueden cursar hacia la deficienciación del sujeto [13] o hacia dificultades en el aprendizaje escolar o social, cuyos correlatos neurológicos es imprescindible conocer. Esto significa que no sólo se construye la inteligencia, sino también la deficiencia mental.
A partir de un estado neurobiológico insuficiente en continua interrelación con el entorno, se puede llegar a un proceso de deficienciación [13], resultado de la interacción continuada entre genética y entorno. De ahí la importancia de conocer minuciosamente la sucesiva organización y el despliegue funcional de conductas que van dando lugar, también sucesivamente, al estado cognitivo y a las posibilidades de aprendizaje de un sujeto.
En este proceso, los primeros años de la vida son cruciales. En ellos acontecen cambios en la estructura y el funcionamiento del lóbulo frontal y en el córtex prefrontal, relacionados con la mielinización, el crecimiento dendrítico y celular, las nuevas conexiones sinápticas y la activación de sistemas neuroquímicos [14,15]. Estos cambios estructurales y funcionales del cerebro se relacionan con ganancias relevantes en las primeras competencias cognitivas, en las funciones ejecutivas [15-17] y en la organización
lógica de la acción y del conocimiento [18,19].
El desarrollo cognitivo se inicia antes de lo esperado tradicionalmente [20]. El neonato dispone de un bagaje inicial, preformado (no innato), que sorprende día a día a los investigadores por su riqueza y plasticidad, permitiendo el primer tratamiento significativo de informaciones y la elaboración de respuestas y conocimientos. Este equipamiento tiene sus raíces en el período fetal (a partir del sexto mes de gestación) y está constituido por la puesta a punto de funciones como: la atención, la percepción, la memoria, la imitación, la lógica y las funciones ejecutivas [17,21,22], así como por diversos dominios de conocimiento: numérico, lingüístico, físico, biológico y psicológico
[21,23,24]. Su puesta a punto y aplicación están relacionadas con la sucesiva corticalización y maduración del córtex frontal y prefrontal [5,7,25] durante los primeros años de la vida.
La influencia del desarrollo temprano para explicar dificultades de aprendizaje en la edad preescolar y escolar [26] está demostrada. Autores como Feinstein et al [27] han hallado alta correlación entre la existencia o no de disfunciones del desarrollo y el nivel intelectual alcanzado durante los primeros 5 años de vida con el nivel intelectual de los 10 años y durante la adultez.
Lo mismo sucede con la investigación en bebés y niños con factores de riesgo de sufrir dificultades cognitivas debidas a factores genéticos, dificultades perinatales, lesiones o malformaciones cerebrales, o factores ambientales [13,28,29]. Todo ello redunda en la necesidad de comprender sólidamente el desarrollo cognitivo y el aprendizaje tempranos [30] mediante la investigación psicológica, genética, neurofisiológica y neuroimagen que permita conocer su soporte estructural y funcionalidad.
El desarrollo cognitivo se posibilita funcionalmente mediante el despliegue de las competencias preformadas, entre las que destacan la lógica (protológica), las funciones ejecutivas y la interacción social. La protológica [31,32] o ‘lógica en acción’ [33] permite, desde el inicio de la vida, la organización de la acción sobre el entorno y la información significativa, dando lugar al saber práctico propio de los primeros años [34].
La eficacia de la actividad lógica y de sus productos reclama la pertinencia del funcionamiento ejecutivo en la planificación, control y flexibilidad en la génesis y aplicación de los esquemas de resolución. Sus componentes más destacados son
tres [35-37]:
– Control de la atención: atención selectiva, atención sostenida e inhibición.
– Establecimiento de un objetivo: iniciativa, planificación, organización y estrategias de resolución.
– Flexibilidad cognitiva: memoria de trabajo, cambio atencional, automonitorización, transferencia entre datos y autorregulación.
La investigación actual concede alta relevancia al papel de las funciones ejecutivas [38]. Aunque su definición no es única, se consideran básicamente un constructo que comprende unas habilidades centrales autorreguladoras, que orquestan procesos básicos o de dominio específico con el fin de lograr un objetivo flexiblemente [39], y que se relacionan con la actividad de regiones corticales y subcorticales que colaboran con el córtex prefrontal. Cumplen funciones de control, supervisión o autorregulación que organizan toda la actividad cognitiva y la emocional.
Las más estudiadas son la inhibición de respuestas dominantes, la planificación y monitorización y el shifting o cambio, todas ellas relacionadas con la flexibilidad cognitiva [40] o con la perseveración e impulsividad [41] si hay fallos en su funcionamiento.
Las funciones ejecutivas cambian con la edad, son decisivas en cuanto al rendimiento social y académico, y tienen expresiones diferenciales según los cursos de desarrollo típico o atípico, respecto a los que explican aspectos importantes. Dado su papel central, los déficit en algunos aspectos condicionan ciertos trastornos, de ahí la importancia de conocer sus raíces e identificar los mecanismos cognitivos subyacentes, como la incapacidad de resistir a la interferencia o la impulsividad.
Los resultados de los escasos estudios con preescolares y recién nacidos muestran su funcionamiento desde el primer año de vida [42]; los cambios en ellas asociados al desarrollo [43-45]; la incidencia de distintas lesiones cerebrales frontales en su funcionamiento; las consecuencias negativas de las diferencias en su organización inicial, manifiestas ya a los 2 años de edad, como la falta de control de respuestas dominantes o la impulsividad [46]; y la existencia de otras manifestaciones de distinta intensidad en el desarrollo de niños con riesgo al nacer [29,46-48] de especial interés por sus efectos en la adquisición de destrezas y conocimientos básicos durante la edad preescolar: el control
de la atención, la planificación, la resolución y adquisición de conocimientos, y la resistencia a distractores en niños prematuros, niños con bajo peso al nacer, niños autistas, niños con déficit de atención e hiperactividad o niños que presentan lesiones frontales. Estas disfunciones no están prefijadas, sino que son la expresión del sucesivo proceso de desarrollo.
Así pues, el funcionamiento cognitivo (resolución de problemas, creatividad o procesamiento de la información) está facilitado por un conjunto de funciones ejecutivas esenciales (o
‘control ejecutivo’) que coordina la consecución de un objetivo, la flexibilidad y la regulación cognitiva. Concretamente, facilitan la toma de decisiones (intencionalidad), la selección y conservación de la información (representación), y la organización lógica y planificación de la acción. Sus componentes fundamentales son filtrar la información irrelevante (supresión de interferencias) e inhibir respuestas predominantes o no adecuadas (inhibición) que enmascaran o dificultan la competencia del niño.
El control cognitivo se desarrolla gradualmente desde el nacimiento y sus ganancias a lo largo de la infancia son esenciales para el funcionamiento cognitivo superior. Se relaciona con la maduración progresiva del córtex prefrontal [42,49,50] hasta la adolescencia, como muestran las medidas sobre mielinización [51], reducción de la materia gris [52], sinaptogénesis [53] y resto de metabolismo [54,55]. Las técnicas de imagen cerebral permiten el examen de esta maduración funcional del circuito neuronal subyacente al funcionamiento cognitivo. En suma, su eficacia o ineficacia puede contribuir a la deficienciación progresiva del desarrollo o conducir hacia dificultades académicas o conductuales [55,56].
Pero no sólo la natura da lugar al desarrollo cognitivo, la interacción social trasciende y modula el funcionamiento neurobiológico individual; es decir, el desarrollo cognitivo es individual y social. Las características de los interactuantes (edad, competencia) y la forma en que se producen los intercambios dan lugar a distintas modalidades de interacción; entre ellas, la tutela es de especial trascendencia en las edades tempranas [57]. La tutela implica la existencia de diferencias en la competencia de los participantes (experto frente a no experto) y de diferentes papeles durante la interacción. Además, como han demostrado
investigaciones anteriores [58,59], la tutela varía según:
a) la gestión del ‘proyecto de acción’ (gestión del niño o del adulto); b) el ajuste del adulto a la competencia y actividad del niño; c) la centración de la propuesta adulta en el resultado de la actividad o en su proceso; y d) el mantenimiento proactivo (durante) o retroactivo (después) de un resultado por parte del adulto hacia la actividad del niño.
Los tipos de tutela, ordenados desde una mayor gestión adulta a una mayor iniciativa infantil, y de un mayor desajuste a un mayor ajuste adulto en las propuestas, son directiva, integración, soporte y laissez faire [58]. Dado que cada uno de estos tipos de tutela ha mostrado su relación con el progreso del ‘tutelado’, es interesante conjugar la organización lógica de la actividad del sujeto, la repercusión en ella del tipo de tutela y la ‘inhibición’ como ‘resistencia a la interferencia’ del bebé (intra) ante una información o esquema no pertinentes o ante una intervención adulta no ajustada (interpersonal).
La manifestación de un mecanismo de inhibición diferenciado en las respuestas infantiles a las propuestas adultas, según sean éstas ajustadas o no, permitirá inferir la capacidad de resistencia a la interferencia como resultado de una inhibición diferenciada, selectiva y eficaz. La presencia de un mecanismo de inhibición indiferenciado hacia las propuestas adultas pondrá en evidencia la ‘no resistencia a la interferencia’. En suma, estos factores, con sus correlatos estructurales y funcionales, permitirán demostrar la eficacia o no del funcionamiento ejecutivo inicial de los pequeños y mejorar nuestro conocimiento.
Qué captar en el desarrollo y aprendizaje tempranos: De acuerdo con lo señalado, conocer funcionalmente el adecuado desarrollo cognitivo inicial y aprendizaje requiere saber cuál
es la capacidad del niño para capturar y elaborar la información mediante su actividad lógica sobre los objetos y sobre la información ofrecida por el adulto. Es preciso comprender el qué y el cómo de la acción del niño en un contexto interactivo durante los primeros años de vida.
Para ello, es preciso determinar, a partir de la acción del niño, la organización lógica de la actividad, su contenido y las funciones ejecutivas, así como la interferencia o facilitación que puede ofrecer un adulto. Y esto debe realizarse comparativamente en distintos cursos de desarrollo temprano, con el fin de identificar posibles diferencias en el contenido lógico de la acción [60], las funciones ejecutivas y los efectos de los tipos de tutela en estos factores. En concreto:
– Actividad del niño sobre los objetos. De acuerdo con Langer [31], actuar es conocer, pero la acción no es igual a conocimiento, es decir, la acción debe ser intencional y organizada
lógicamente para obtener un producto cognitivo. Además, las acciones están comprendidas en otras más complejas [61] para conseguir un objetivo. Necesitamos conocer, paso a paso, el contenido de la acción intencional, el curso de las acciones, sus resultados y sus consecuencias en la redescripción de la actividad, así como el papel de las funciones
ejecutivas en la obtención de resultados.
– Funciones ejecutivas. La planificación, el control de la actividad y la flexibilidad dependen de la aplicación de las funciones ejecutivas. Las más relevantes para ello son la inhibición y la activación eficaces (shifting). La inhibición se relaciona con el control y la planificación: a) detiene la ejecución e una acción predominante o el procesamiento de una información irrelevante; b) selecciona las acciones y representaciones pertinentes y representaciones en una actividad; y c) favorece el consecuente shifting o activación eficaz después de una señal de parada. En suma, la inhibición favorece la emergencia de un nuevo esquema o su modulación (shifting) y la resistencia a la interferencia, todo ello relacionado con la flexibilidad mental y la no impulsividad.
El fallo en la inhibición de una respuesta o información inapropiadas conduce a la perseveración [49], o sea, a una activación repetida sin modificaciones de una acción dominante [62]. La perseveración está considerada como una característica funcional presente en varios tipos de psicopatología y dificultades del desarrollo derivadas generalmente de lesiones o disfunciones en el córtex prefrontal. La investigación indica
que tiene lugar en distintos contextos y edades y que comporta un fallo en el control de la respuesta inadecuada que, a su vez, incide en la rigidez representacional [63] de funcionamiento.
Esto supone que, en el curso del desarrollo cognitivo, los recursos de inhibición deben incrementarse con la edad [17,45] a la vez que declina la perseveración. Estas funciones
ejecutivas deben estudiarse en referencia a la habilidad infantil para resistir a la interferencia (información no pertinente) y para el mantenimiento de un objetivo
(proyecto de acción), hacia el funcionamiento cognitivo correcto.
– Interacción. Los niños no actúan solos, por ello es necesario investigar el contexto interactivo a lo largo de la resolución de la tarea.
De acuerdo con Haan et al [12], los factores genéticos y su interacción
con factores externos contribuyen al proceso de desarrollo, incluso
prenatalmente. La figura 1 muestra los componentes de una situación interactiva [64].
En consecuencia, hemos estudiado diferencialmente en bebés típicos y bebés con síndrome de Down, entre 11 meses y 24 meses de edad, el contenido y la organización lógica de su acción, los tipos de tutela adulta en relación con las ganancias del niño, así como su capacidad para resistir la interferencia de las propuestas desajustadas de aquél. Los resultados muestran la existencia de diferencias significativas en la organización lógica de la acción y en los mecanismos de representación [60], así como en el distinto
tipo de tutela y sus consecuencias, destacando la diferente resistencia a la interferencia provocada por el adulto, como indica la tabla I [65].
Partiendo de estos resultados, el objetivo es conocer el funcionamiento ejecutivo temprano en grupos de bebés con cursos diferenciales de desarrollo comprendiendo también el de bebés con factores de riesgo al nacer. Focalizamos la atención en las funciones ejecutivas de inhibición, interferencia, perseveración y shifting, y en sus consecuencias en la flexibilidad mental, el mantenimiento de un objetivo y el control de la acción a temprana edad. Esperamos conocer si en estas edades existe un gradiente diferencial de funcionamiento que pudiera explicar diferencialmente sus competencias.
SUJETOS Y MÉTODOS
Sujetos
Han participado 28 bebés con cursos de desarrollo diferencial: 10 bebés típicos, seis bebés con patología establecida al nacer (bebés con síndrome de Down) y 12 bebés con factor de riesgo al nacer, seis de ellos con hipotiroidismo congénito y seis con bajo peso. Se han extraído de escuelas infantiles (bebés típicos) y de los hospitales San Millán de Logroño y Fundación Hospital de Calahorra (bebés con síndrome de Down y bebés con factor de riesgo al nacer).
Los bebés típicos se han estudiado a la edad cronológica de 1,3 y 2 años.
El primer registro de los bebés con síndrome de Down y de los bebés con factor de riesgo al nacer se realizó tras alcanzar una edad de desarrollo cognitivo equivalente a 1,3 años [66], independientemente de su edad cronológica, y la segunda, nueve meses después.
Instrumentos
El material de estímulo creado ad hoc consiste en una tarea no verbal que permite la ejecución de distintos cursos de acción organizada y la ejecución de operaciones lógicas, y favorece el estudio de mecanismos de variaciónselección (activación-inhibición-shifting) (Fig. 2).
Procedimiento
Se registra audiovisualmente, la actividad espontánea del niño en un lugar conocido por él y con el material de estímulo, a los 1,3 años y 9 meses después, durante un tiempo medio de 15 minutos. El niño se sienta frente al material acompañado de un adulto con la consigna de intervenir sólo: a) ante la demanda directa del bebé; b) ante la detención de su actividad; y c) si el bebé ejecuta una actividad repetitiva.
Se realiza un doble análisis de datos:
– Para inferir los procesos intra e intergrupales confiriéndoles sentido psicológico. Con este fin, se aplican: a) la metodología de observación sistemática [67], que permite capturar fiablemente la realidad en su continuo extrayendo y codificando las unidades de conducta y sus componentes secuenciales; y b) el análisis microgenético del contenido de la realidad tanto funcional –mostrando la organización secuencial–, como intensivo –basado en un amplio número de observaciones– y secuencial.
Para ello, se elabora un sistema mixto de categorías y formatos de campo con un diseño lag-log [67], en torno a ocho macrocategorías, de las que se extraen las relativas a las funciones ejecutivas que figuran en la tabla II [68]. Codificada y cuantificada la actividad del bebé con las microcategorías señaladas, y asegurado el control de la calidad de los datos mediante el cálculo del coeficiente de Krippendorf (α = 0,83), se procede a su análisis intragrupal.
– Cálculo de las proporciones y diferencias significativas intra e intergrupo. Se cuantifican las unidades de conducta relacionadas con el funcionamiento ejecutivo de los
bebés pertenecientes a cada uno de los grupos estudiados, calculando la significatividad de la proporcionalidad diferencial mediante el estadístico de contraste:
P – Π
Z = ———————
√ Π (1 – Π) / N
RESULTADOS
Extraemos, entre los resultados obtenidos, los que hacen referencia a las diferencias de funcionamiento ejecutivo en cada uno de los grupos estudiados, correspondientes a los 1,3
y 2 años de edad.
En primer lugar, la tabla III recoge la proporcionalidad en la aparición de las distintas
unidades de conducta ejecutiva para cada grupo y cada una de las sesiones analizadas (1,3 y 2 años) que permitirá calcular la significatividad de las diferencias intragrupo.
En general, se observa una mejora en los índices de flexibilidad entre la primera y última
sesión, especialmente entre los bebés con síndrome de Down, aunque los valores obtenidos
por estos últimos no alcancen los de los bebés típicos en la primera sesión. En los grupos
de bebés con factores de riesgo y de bebés con síndrome de Down, la perseveración
(ACT) está presente, aunque disminuye a los 24 meses, hasta desaparecer entre los primeros.
En los bebés con síndrome de Down disminuye la perseveración en la segunda sesión, pero sus valores están por encima de cualquier grupo.
En las tablas IV, V, VI y VII se recogen las diferencias significativas intragrupo para cada una de las sesiones analizadas. Para interpretarlas correctamente, hay que considerar
en su lectura que las diferencias significativas con signo positivo corresponden a mayor puntuación durante los 1,3 años, mientras que las de signo negativo incrementan la puntuación sobre la segunda sesión (2 años) (Fig. 3).
Las diferencias significativas de las conductas aparecidas entre los 15 y los 24 meses muestran, en general, un progreso en los indicadores de flexibilidad (SH2, AUC, COM)
de funcionamiento. En la segunda sesión aumenta el número de resultados obtenidos (RE), el bebé es capaz de autocorregir la acción para ajustarla mejor al objetivo (AUC) y aumenta la combinación de acciones que se encadenan y amplían sucesivamente (COM).
Se produce, además, un avance en la modulación de la actividad para conseguir un mismo objetivo (SH2) que, aunque no llega a ser significativo (–1,02), es un índice de cambio positivo en el uso y los efectos de los mecanismos ejecutivos.
La visión del desarrollo se completa valorando lo que no aumenta entre la primera y la segunda sesión. Hay disminución significativa (1,98) del número de cambio de objetivos en una misma acción (SH1), es decir, es la acción en curso la que se modula, amplía y combina con otras realizadas previamente (SH2, MIS,AUC, COM). Además, disminuyen las interrupciones
de una acción iniciada (DET) y no se observa la perseveración (ACT) en ninguna sesión. Todo ello es coherente con la planificación y el control de la acción, lo que redunda en una mayor organización lógica.
En suma, hay un avance significativo en la mejora del funcionamiento ejecutivo de los bebés típicos entre los 15 y los 24 meses, así como en lo que caracteriza dicho funcionamiento (unidades de conducta estudiadas) y en su repercusión directa en la flexibilidad, planificación y obtención de resultados durante un curso de actividad voluntaria e intencional.
Esa mejora y las características que la definen son punto de referencia para comparar los mismos indicadores entre los otros grupos estudiados (Fig. 4).
Aunque se constatan diferencias entre los aspectos de desarrollo estudiados, dichas diferencias no son tan evidentes como las obtenidas entre los bebés típicos. En concreto, disminuye significativamente la perseveración (ACT).
Otras tendencias de cambio, aunque no llegan a ser significativas, consisten en que:
– La acción se modula y redefine para conseguir un mismo objetivo (1,69) (SH2), con una ligera disminución (0,65) del cambio de objetivos dentro de una acción continuada (SH1) a los 24 meses.
– La integración de varias acciones para conseguir un objetivo (COM).
– El ligero aumento (–0,20) en la obtención de resultados estables (RE) por combinación de acciones distintas a los 24 meses.
La riqueza de acción, aunque menor, se acerca a la de los bebés típicos. Hay buena planificación, inhibición y flexibilidad de funcionamiento de partida, aunque no muestren el mismo nivel de redescripción que entre los bebés típicos.
Los resultados referentes al grupo de bebés con bajo peso al nacer se recogen en la tabla VI (Fig. 5). La actividad de los niños de bajo peso muestra un avance en la flexibilidad de los 15 a los 24 meses, aunque no tan notorio como el de los bebés típicos. El cambio es mayor que el detectado entre los bebés hipotiroideos, pero sobre un estado inicial de flexibilidad e iniciativa menores respecto a aquéllos.
El avance es ligero en aspectos tan importantes como el uso de nuevos esquemas (NES), la detección de errores para ensayar formas nuevas en la consecución del objetivo (AUC), o la integración de diferentes esquemas para conseguir los objetivos (COM). Los niveles de significación respectivos son –0,28, –0,22 y –1,44.
A estos resultados hay que añadir otro aspecto positivo: la desaparición a los 24 meses de las acciones repetitivas presentes a los 15 meses (ACT), indicativa de la progresiva flexibilización del funcionamiento ejecutivo aplicado a la organización de la actividad y a la extracción de resultados.
En conjunto, el proceso de desarrollo muestra un avance progresivo en la flexibilidad de funcionamiento intelectual entre los bebés de bajo peso, quienes, en cuanto a la riqueza de contenido, son similares pero con menor espontaneidad e iniciativa a los bebés hipotiroideos, a quienes no llegan a igualar a los 2 años. Por lo tanto, se sitúan cercanos a éstos y un poco más alejados del ‘patrón’ de contenido y ejecución de los bebés con desarrollo típico.
La tabla VII representa los resultados de los bebés con síndrome de Down (Fig. 6). Aunque la riqueza del contenido de la actividad es la menor entre los grupos estudiados, los resultados obtenidos indican una mejora sustancial entre los 15 y los 24 meses, a la vez que se optimizan varias unidades de conducta hacia la mayor flexibilidad y, en general, eficacia del funcionamiento ejecutivo inicial, basadas en: a) la obtención de mayor número de resultados (RE); b) la menor perseveración (ACT) –aunque aún presente–; y c) la mayor combinación (COM) entre acciones ya realizadas (MIS) en la secuencia de actividad y otras nuevas (NES) que la enriquecen.
Ello indica que, a pesar de la menor riqueza de partida y mayor dificultad ejecutiva, hay una mejora en el funcionamiento cognitivo de estos bebés. Esto es una muestra de que su potencial ejecutivo puede ser modulado y/o optimizado, lo cual revierte en el mayor sentido de una intervención temprana eficaz que asiente sobre estas posibilidades para obtener entre ellos un desarrollo más armónico y estructurado.
DISCUSIÓN
Los resultados obtenidos sugieren la existencia de diferencias significativas intergrupo en la inhibición y activación eficientes:
– Existen diferencias en el funcionamiento ejecutivo de cada uno de los grupos estudiados a los 1,3 y a los 2 años, con una tendencia hacia la mayor eficacia y flexibilidad, aunque hay diferencias entre ellos.
– Las mayores diferencias intergrupo están entre los bebés con síndrome de Down y los bebés
típicos. Los bebés con factores de riesgo ocuparían un gradiente entre el funcionamiento ejecutivo de los bebés típicos y el de los bebés con síndrome de Down más cerca de los primeros, pero con ciertas diferencias, siendo el funcionamiento de los bebés hipotiroideos el más próximo a ellos.
– La principal diferencia intergrupos es la eficiencia de los mecanismos de inhibición/activación.
Hay mayor frecuencia de la perseveración en los bebés con síndrome de Down –que no desaparece a los 24 meses– asociada con una menor combinación y redefinición eficiente de la inhibición/activación (shifting). La perseveración no está presente entre los bebés típicos.
Entre los bebés con riesgo tiene mayor frecuencia en los bebés con bajo peso a los 1,3 años, pero desaparece a los 2 años; mejora, por tanto, su flexibilidad e inhibición pertinentes.
Además, los bebés con síndrome de Down constituyen el grupo con menor mantenimiento del objetivo de la tarea (planificación).
Las diferencias encontradas entre los grupos estudiados permiten extraer pautas de naturaleza educativa dirigidas hacia la armonización y mejora del desarrollo cognitivo temprano. Estos resultados que corroboran el desarrollo diferencial de la eficacia ejecutiva [46,56] podrían optimizarse con la obtención de imágenes cerebrales.
Figuras y tablas:
Figura 1. Componentes de la actividad interactiva.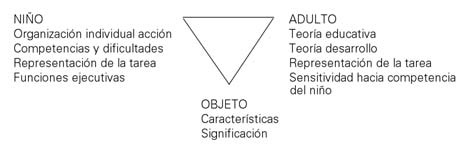
Figura 2. Material de estímulo.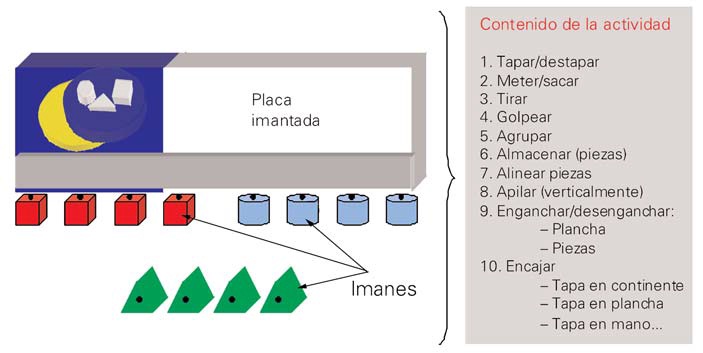

Figura 3. Bebés típicos.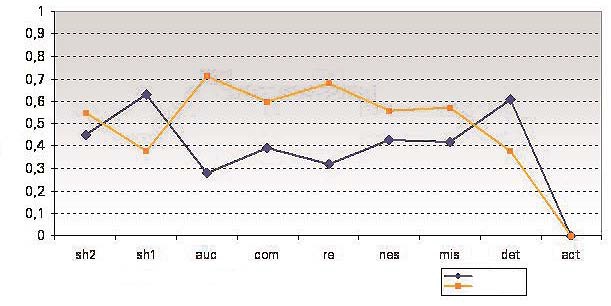
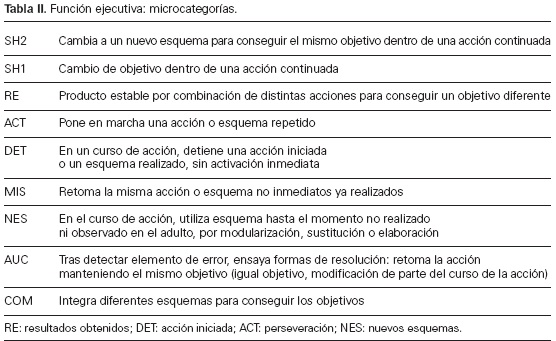
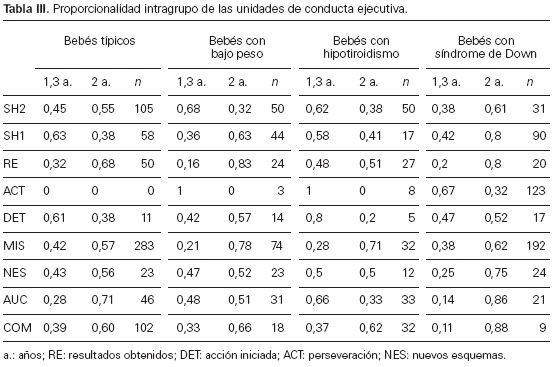
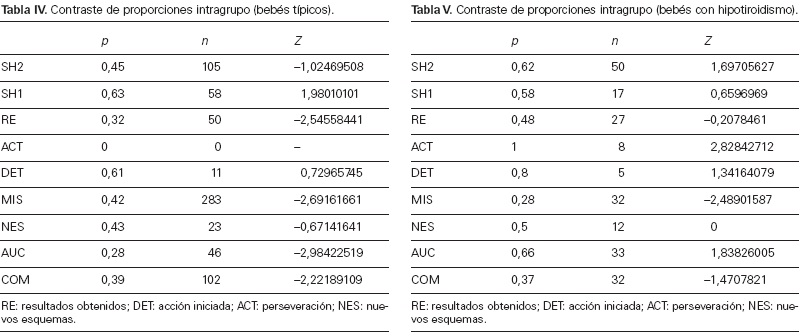
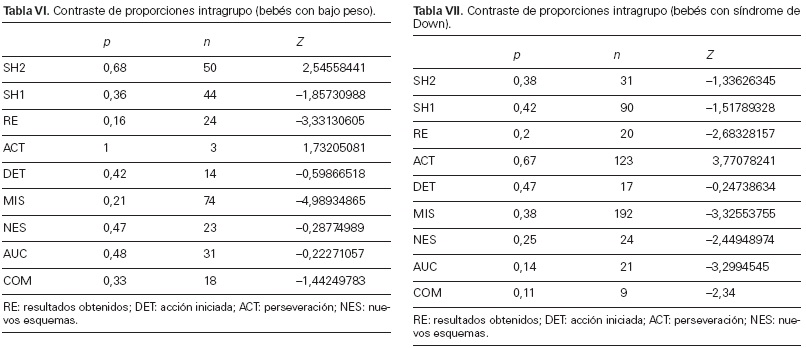
Figura 4. Bebés hipotiroideos.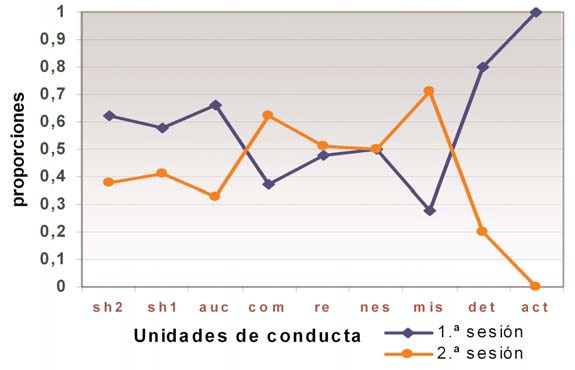
Figura 5. Bebés de bajo peso.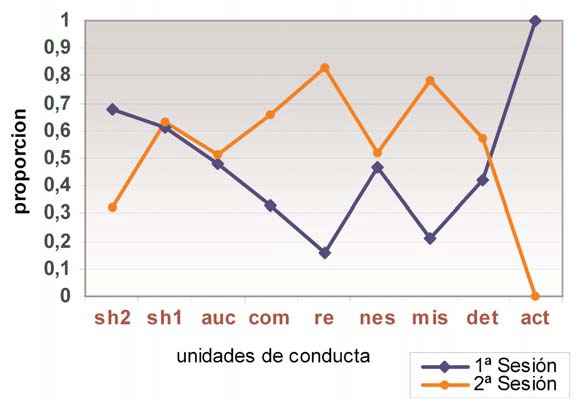
Figura 6. Bebés con síndrome de Down.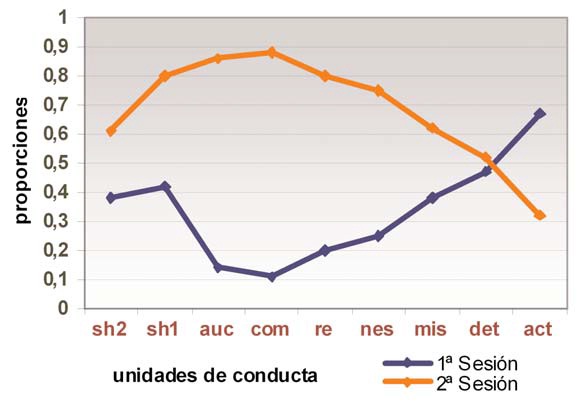
BIBLIOGRAFÍA
1. Johnson MH. Functional brain development in infants: elements of an interactive specialization framework. Child Dev 2000; 71: 75-81.
2. Johnson SP. The nature of cognitive development. Trends Cogn Sci 2003; 7: 102-4.
3. Diamond A. Frontal lobe involvement in cognitive changes during the first year of life. In Gibson KR, Petersen AC, eds. Brain maturation and cognitive development: comparative and cross-cultural perspective. New York: Aldine de Gruyter; 1991. p. 67-110.
4. Munakata Y, Casey BJ, Diamond A. Developmental cognitive neuroscience: progress and potential. Trends Cogn Sci 2004; 8: 122-8.
5. Quartz SR, Sejnowski TJ. The neural basis of cognitive development: a constructivist manifesto. Behav Brain Sci 1997; 20: 537-96.
6. Petrill SA, Plomin R, Defries JC, Hewitt JK. Nature, nurture and the transition to early adolescence. New York: Oxford University Press; 2003.
7. Huttenlocher PR. Neural plasticity: the effect of environment on the development of cerebral cortex. Cambridge, MA: Harvard University Press; 2002.
8. Zesiger P. Pour une neuropsychologie développementale cognitive. Enfance 2003; 4: 327-36.
9. Huttenlocher PR, Dabholkar AS. Regional differences in synaptogenesis in human cerebral cortex. J Comp Neurol 1997; 87: 167-78.
10. Catherwood D. New views on the young brain: offerings from developmental psychology to early childhood education. Contemporary Issues Early Childhood 2000; 1: 23-35.
11. Karmiloff-Smith A. Promissory notes, genetic clocks, and epigenetic outcomes. Behav Brain Sci 1997; 20: 355-60.
12. Haan M, Johnson MH, eds. The cognitive neuroscience of development. Hove: Psychology Press; 2003.
13. Cambrodí A. Psicología evolutiva de la deficiencia mental. Barcelona: Herder; 1983.
14. Christoff K, Gabrieli J. The frontopolar cortex and human cognition: evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology 2000; 28: 168-86.
15. Diamond A. Neuropsychological insights into the meaning of object concept development. In Johnson MH, ed. Brain development and cognition. Cambridge: Blackwell; 1996. p. 208-47.
16. Diamond A. Normal development of prefrontal cortex from birth to young adulthood: cognitive functions, anatomy and biochemistry. In Stuss DT, Knight RT, eds. Principles of frontal lobe function. London: Oxford University Press; 2002. p. 466-503.
17. Diamond A. Prefrontal cortex development and development of cognitive functions. In Smelser NJ, Baltes PB, eds. The international encyclopedia of the social and behavioral sciences. London: Elsevier Press; 2001. Vol. 4.3, art. 198.
18. Verba M. The beginnings of collaboration in peer interaction. Hum Dev 1994; 38: 125-39.
19. Crinella FM,Yu J. Brain mechanisms and intelligence: psychometric g and executive function. Intelligence 2000; 27: 299-327.
20. Piaget J. The construction of reality in the child. New York: Basic Books; 1954.
21. Goswami U. Cognition in children. East Sussex: Psychology Press; 1998.
22. Mehler J, Dupoux D. Nacer sabiendo. Madrid: Alianza; 1992.
23. Wynn K. Addition and substraction by human infants. Nature 1992; 358: 749-50.
24. Carey S. Sources of conceptual change. In Scholnik EK, Nelson K, Gelman SA, Millar PH, eds. Conceptual development: Piaget’s legacy. Mahwah, NJ: Erlbaum; 1999. p. 293-326.
25. Diamond A. Normal development of prefrontal cortex from birth to young adulthood: cognitive functions, anatomy and biochemistry. In Stuss DT, Knight RT eds. Principles of frontal lobe function. London: Oxford University Press; 2002. p. 466-503.
26. Isquith P, Crawford J, Espy KA, Gioia GA. Assessment of executive function in preschool-aged children. Mental Retard Dev Disabil Res Rev 2005; 11: 209-15.
27. Feinstein L, Bynner J. The importance of cognitive development in middle childhood for adult socioeconomic status, mental health and problem behavior. Child Dev 2004; 75: 1329-39.
28. Mellier D, Fessard C. Preterm birth and cognitive inhibition. Eur Rev Appl Psychol 1998; 48: 13-8.
29. Sommerfelt K, Andersson HW, Sonnander K, Ahlsten G, Ellertsen B, Markestad T, et al. Cognitive development of term small for gestational age children at five years age. Arch Disabl Child 2000; 83: 25-30.
30. Regnier R. Neurophysiological evaluation on early cognitive development in high-risk infants and toddlers. Mental Retard Dev Disabil Res Rev 2005; 11: 317-24.
31. Langer J. Early cognitive development: basic functions. In Hauert CA, ed. Developmental psychology: cognitive, perceptuo-motor and neuropsychological. Perspectives. Amsterdam: North Holland; 1990. p.19-42.
32. Langer J. The heterochronic evolution of primates. In Parker ST, Langer J, McKinney L, eds. Cognitive development in biology, brains and behavior. Oxford: James Currey; 2001. p. 215-36.
33. Piaget J, García R. Hacia una lógica de significaciones. Barcelona: Gedisa; 1987.
34. Pastor E, Sastre S. Desarrollo de la inteligencia. In Bermejo V, ed. Desarrollo cognitivo. Madrid: Síntesis; 1994. p. 191-213.
35. Anderson P, Doyle L. Neurobiological outcomes of school-age children born extremely low birth weight or very preterm. J Am Med Assoc 2003; 289: 3264-72.
36. Zelazo PH. The development of conscious control in childhood. Trends Cogn Sci 2004; 8: 12-7.
37. Shallice T. From Neuropsychology to mental structure. Cambridge: Cambridge University Press; 2001.
38. Baddeley AC. Working memory. Science 1992; 255: 566-69.
39. Elliott R. Executive functions and their disorders. Br Med Bull 2003; 65: 49-59.
40. Deak G, Narasimham G. Is perseveration caused by inhibition failure? Evidence from preschool children’s inferences about word meanings. J Exp Psychol 2003; 86: 194-222.
41. Aksan N, Kochanska D. Links between systems of inhibition from infancy to preschool years. Child Dev 2004; 75: 1477-90.
42. Diamond A. Understanding the A-non B error: working memory versus reinforced response or active trace versus latent trace. Dev Sci 1998; 1: 185-9.
43. Diamond A, Kirkham NZ. Not quite as grown-up as we like to think: parallels between cognition in childhood and adulthood. Psychol Sci 2005; 16: 291-7.
44. Zelazo Ph, Müller U, Frye D, Marcovitch S. The development of executive function in early childhood. Boston: Blackwell Publishing; 2003.
45. Jacques S, Zelazo PH. The flexible item selection task (FIST): a measure of executive function in preschoolers. Dev Neuropsychol 2001; 20: 573-91.
46. Bunge S, Dukovic NM, Thomason ME, Vaidya CJ, Gabrieli JD. Inmature frontal lobe contributions to cognitive control in children: evidence from MRI. Neuron 2002; 33: 301-11.
47. Anderson P, Doyle L. Neurobiological outcomes of school-age children born extremely low birth weight or very preterm. J Am Med Assoc 2003; 289: 3264-72.
48. Mellier D, Fessard C. Preterm birth and cognitive inhibition. Eur Rev Appl Psychol 1998; 48:13-8.
49. Dempster Fr, Corkill AJ. Individual differences to interference and general cognitive disability. Acta Psychologica 1999; 101: 395-416.
50. Dempster FN. The rise and fall of inhibitory mechanism: toward a unified theory of cognitive development and aging. Dev Rev 1992; 12: 45-75.
51. Giedd J.N, Blumenthal J, Jeffries NO, Castellanos FX, Liu FX, Zijdenbos A, et al. Brain development during childhood and adolescence: a longitudinal MRI study. Nat Neurosci 1999; 2: 861-3.
52. Sowell ER, Delis D, Jemigan TL. Improved memory functioning and frontal lobe maturation between childhood and adolescence: a structural MRI study. J Int Neuropsychol Soc 2001; 7: 312-22.
53. Huttenlocher PR. Synaptic density in human frontal cortex developmental changes and effects in aging. Brain Res 1979; 163: 195-205.
54. Diamond A. Normal development of prefrontal cortex from birth to young adulthood: anatomy and biochemistry. In Stuss DT, Knight RT, eds. Principles of frontal lobe function. London: Oxford University Press; 2002.
55. Miranda A. Trastornos por déficit de atención con hiperactividad: una guía práctica. Málaga: Aljibe; 2001.
56. Etchepareborda MC, Mulas F, Capilla A, Fernández S, Campo P, Maestu F, et al. Sustrato neurofuncional de la rigidez cognitiva en el TDAH: resultados preliminares. Rev Neurol 2004; 38 (Sup 1): S145-8.
57. Verba M. Tutoring interactions between young children: how symmetry can modify asymmetrical interactions. Int J Behav Dev 1998; 22: 195-216.
58. Sastre S, Pastor E. Modalidades de tutela de gestión cognitiva en bebés trisómicos. Infancia y aprendizaje 2001; 93: 35-52.
59. Sastre S, Verba M. Les interactions de tutelle avec les bébés normaux et les enfants trisomiques: l’apport de l’enfant dans l’ajustement de l’adulte. Enfance 2001; 2: 197-214.
60. Pastor E, Sastre S. Desarrollo de la inteligencia. In Bermejo V, ed. Desarrollo cognitivo. Madrid: Síntesis; 1994. p.191-213.
61. Jeannerod J. The cognitive neuroscience of action. Cambridge: Blackwell Publishers; 1997.
62. Dempster FN, Brainerd CJ. Interference and inhibition in cognition. New York: Academic Press; 1995.
63. Kirkham NZ, Cruess L, Diamond A. Helping children apply their knowledge
to their behavior on a dimension-switching task. Dev Sci 2003; 6: 449-67.
64. Sastre S. Tutoring adjustment and infant’s cognitive gain. In Anolli L, Duncan S, Magnusson M, Riva G, eds. Amsterdam: IOS Press; 2004. p.195-208.
65. Sastre S, Escolano E, Merino N. Observación sistemática en la cognición temprana: funciones ejecutivas, lógica e interacción. Metodología de las Ciencias del Comportamiento 2004 (Supl): S555-63.
66. Cambrodi A, Sastre S. Escales d’observació sistemàtica 0-3 anys. Barcelona: PPU; 1993.
67. Anguera MT. Metodología observacional. In Arnau J, Anguera MT, Gómez J, eds. Metodología de la investigación en ciencias del comportamiento.
Murcia: Secretariado de ublicaciones de la Universidad de Murcia; 1999. p.125-236.
68. Sastre S, Poch ML, Escorza J. Differential patterns on early executive functioning. Child Dev 2006 [in press].
Aceptado: 30.01.06.
Departamento de Ciencias Humanas y Sociales. Universidad de La Rioja.
Logroño, La Rioja, España.
Correspondencia: Dra. Sylvia Sastre i Riba. Departamento de Ciencias Humanas
y Sociales. Universidad de La Rioja. Luis de Ulloa, s/n. E-26004 Logroño
(La Rioja). Fax: +34 941 299 318. E-mail: [email protected].
Este trabajo ha recibido el soporte del Proyecto Nacional de Investigación
PB98-0207-C02-01 y de la Consejería de Salud del Gobierno de La Rioja (OTCA 19227).
© 2006, REVISTA DE NEUROLOGÍA

